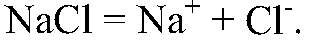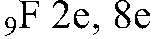Сущность процесса электрической диссоциации - cтраницы 20, 21, 22, 23, 24, 25, 26
1. Поясните, почему раствор сахара не проводит электрический ток, а раствор хлорида натрия проводит?
Раствор поваренной соли является электролитом. При растворении в воде ионная кристаллическая решетка
разрушается:
Раствор сахара не является электролитом. Молекулы сахара имеют ковалентную неполярную связь, при растворении сахара в воде разрушение его молекулы и образование заряженных ионов не происходит, поэтому такой раствор электрического тока не проводит.
2. Перечислите основные причины, вызывающие распад некоторых веществ на ионы при растворении их в воде или расплавлении.
Разрушение ионной кристаллической решётки под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
3. Укажите различия в строении и свойствах ионов и атомов, например, для кальция и фтора.
Атом кальция -
Ион кальция -
Атом кальция создает наружные электроны, поэтому химически активен, является щелочноземельным металлом, взаимодействует с галогенами, окисляется в сухом воздухе, энергично реагирует с кислотами, при нагревании взаимодействует с такими веществами, как
Ион кальция не отдает электроны, поэтому не окисляется, т.е. не является химически активным.
Атом фтора -
Ион фтора -
Атом фтора может присоединить недостающий один электрон, является самым активным галогеном, образует соединения практически со всеми элементами (кроме инертных газов) - фториды, сильный окислитель и акцептор. Ион фтора не может присоединить электроны, т.к. внешняя оболочка иона полностью заполнена, входит в состав солей- фторидов.
4. Определите массу сульфида меди II, образовавшегося в результате взаимодействия 5 моль сульфата меди II с сероводородной кислотой, взятой в избытке.
Решение
CuSO4 + H2S(насыщ. ) = CuS↓ + H2SO4
n(CuSO4)= n(CuS) = 5 моль
m(CuS) = 5моль*96г/моль= 480 г
Ответ: 480 г.
Сохраните или поделитесь с одноклассниками: