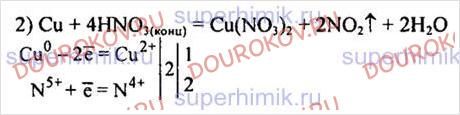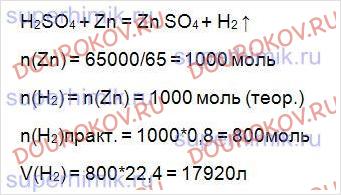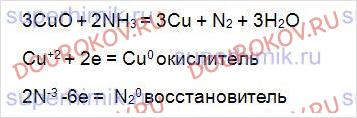Неметаллы. 3 уровень - cтраницы 126, 127, 128
ВАРИАНТ 1
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов: С →СН4 → ... →CaCO3→ ... → CaCO3. Рассмотрите все реакции в свете ОВР и ТЭД везде, где это имеет место.
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой Zn + 2НС1 = ZnCl2 + H2↑ + Q, по всем изученным признакам классификации. Рассмотрите реакцию с точки зрения ТЭД.
ЗАДАНИЕ 3
Закончите уравнение ОВР, расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель: Сu + HN03(paз6) →.
ЗАДАНИЕ 4
К 160 кг 10%-го раствора сульфата меди (II) прибавили избыток железных опилок. Какая масса меди выделилась, если выход продукта составил 90% от теоретически возможного?
ВАРИАНТ 2
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов: N2 →... →NO →N02 →... →Cu(N03)2. Рассмотрите все реакции в свете ОВР и ТЭД везде, где это имеет место.
ЗАДАНИЕ 2
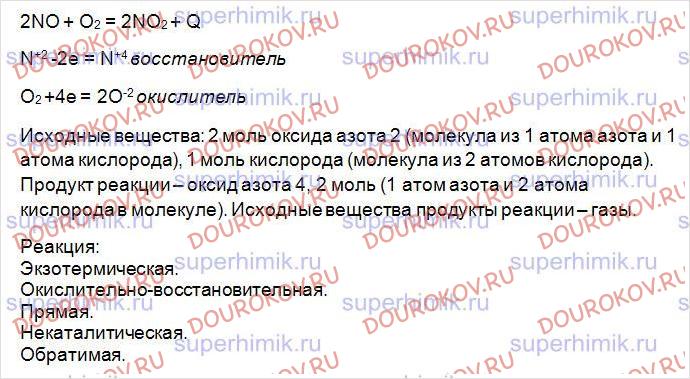
Дайте характеристику реакции, уравнение которой 2NO + 02 <=> 2N02 + Q, по всем изученным признакам классификации. Рассмотрите данную реакцию в свете ОВР.
ЗАДАНИЕ 3
Закончите уравнение ОВР и расставьте коэффициенты в нем методом электронного баланса, укажите окислитель и восстановитель: Сu + НNОз(конц.} →.
ЗАДАНИЕ 4
ЦИНК массой 6,5 кг обработали избытком раствора серной кислоты. Определите объем выделившегося газа, если выход продукта реакции составил 80% от теоретически возможного.
ВАРИАНТ 3
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов: S →FeS →S02 →... →H2S04 →... . Рассмотрите все реакции в свете ОВР и ТЭД везде, где это имеет место.
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой С02 + С <=> 2СО - Q, по всем изученным признакам классификации. Рассмотрите данную реакцию в свете ОВР.
ЗАДАНИЕ 3
Закончите уравнение ОВР и расставьте коэффициенты в нем методом электронного баланса, укажите окислитель и восстановитель: Zn + H2S04(KOHЦ) →.
ЗАДАНИЕ 4
Какой объем водорода выделится при взаимодействии 13 г цинка с избытком раствора серной кислоты? Объемная доля выхода водорода составляет 90% от теоретически возможного.
ВАРИАНТ 4
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов: Si →...→ Na2Si03 →...→ Si02. Рассмотрите все реакции в свете ОВР и ТЭД везде, где это имеет место.
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой H20(nap) + C0<=>H2 + C02-Q, по всем изученным признакам классификации. Рассмотрите данную реакцию в свете ОВР.
ЗАДАНИЕ 3
В схеме ОВР расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель: NH3 + CuO→N2 + ... + ... .
ЗАДАНИЕ 4
10 кг оксида магния обработали избытком раствора азотной кислоты. Какая масса соли образовалась, если выход соли составил 80% от теоретически возможного?
Сохраните или поделитесь с одноклассниками: