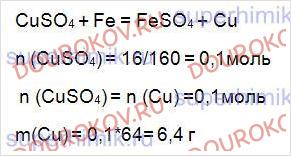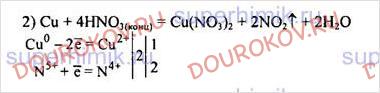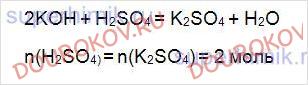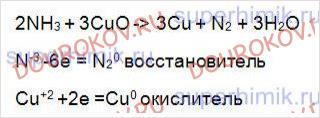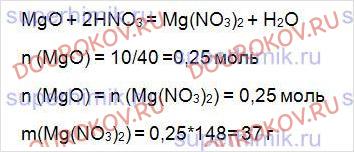Неметаллы. 1 уровень - cтраницы 120, 121, 122, 123
ВАРИАНТ 1
ЗАДАНИЕ 1
Напишите уравнения реакций для следующих переходов: С →С02 →СаС03 →СаС12 →СаС03. Превращение 1 рассмотрите в свете ОВР, 4 - в свете ТЭД.
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой N2 + ЗН2 <=> 2NH3 + Q, по всем изученным признакам классификации.
Рассмотрите данную реакцию с точки зрения ОВР.
ЗАДАНИЕ 3
В схеме ОВР расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Сu + HN03(paз6) → CU(N03)2 + NO + Н20.
ЗАДАНИЕ 4
К раствору, содержащему 16 г сульфата меди (II), прибавили избыток железных опилок. Какая масса меди выделилась при этом?
ВАРИАНТ 2
ЗАДАНИЕ 1
Напишите уравнения реакций для следующих переходов: N2 → NO → N02 →HN03 →CU(N03)2. Превращение 1 рассмотрите в свете ОВР, 4 - в свете ТЭД.
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой 2N0 + 02 <=> 2N02 + Q, по всем изученным признакам классификации.
Рассмотрите данную реакцию с точки зрения ОВР.
ЗАДАНИЕ 3
В схеме ОВР расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Сu + НNO3(КОНЦ) → Cu(N03)2 + N02 + Н20.
ЗАДАНИЕ 4
6,5 г цинка обработали достаточным количеством разбавленного раствора серной кислоты. Определите объем выделившегося водорода.
ВАРИАНТ 3
ЗАДАНИЕ 1
Напишите уравнения реакций для следующих переходов: S → S02 →S03 H2S04 →BaS04. Превращение 1 рассмотрите в свете ОВР, 4 - в свете ТЭД.
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой С02 + С <=> 2СО - Q, по всем изученным признакам классификации. Рассмотрите данную реакцию с точки зрения ОВР.
ЗАДАНИЕ 3
В схеме реакции расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель: Zn + H2S04(KOHц) → ZnS04 + H2S↑ + H20.
ЗАДАНИЕ 4
Определите количество вещества сульфата калия, полученного при сливании избытка раствора гидроксида натрия с раствором, содержащим 2 моль серной кислоты.
ВАРИАНТ 4
ЗАДАНИЕ 1
Напишите уравнения реакций для следующих переходов: Si → Si02 →Na2Si03 →H2Si03 →Si02. Превращение 1 рассмотрите в свете ОВР, 3 - в свете ТЭД.
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой Н20(пар) + СО <=> Н2 + С02 - Q, по всем изученным признакам классификации. Рассмотрите данную реакцию с точки зрения ОВР.
ЗАДАНИЕ 3
В схеме реакции расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель: NH3 + CuO→ N2 + Сu + Н20.
ЗАДАНИЕ 4
10 г оксида магния обработали раствором азотной кислоты. Какая масса соли образовалась?
Сохраните или поделитесь с одноклассниками: