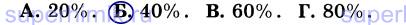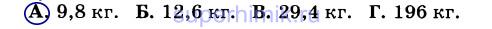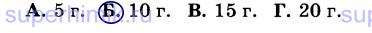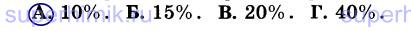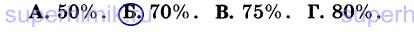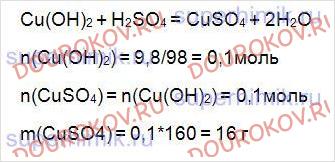Количественные отношения в химии. 4 вариант - cтраницы 86, 87
8. В закрытом сосуде взорвали смесь, состоящую из 2 объемов угарного газа (СО) и 1 объема кислорода. После реакции в сосуде присутствуют вещества:
9. В избытке соляной кислоты раство¬рили 200 г мрамора. После реакции осталось 20 г нерастворившегося вещества. Массовая доля некарбонатных примесей равна:
10. При разложении гидроксида меди (II) массой 98 г (Cu(OH)2 = СuО + Н20) получили 56 г СuО. Массовая доля выхода продукта реакции от теоретически возможного равна:
ЧАСТЬ Б. Задания со свободным ответом
11. К 9,8 г гидроксида меди (II) добавили избыток раствора серной кислоты. Рассчитайте массу образовавшейся соли.
12. По термохимическому уравнению реакции
СН4 + 202 = С02 + 2Н20 + 890 кДж, рассчитайте количество теплоты, выделяющейся при сгорании 89,6 л метана СН4.
13. Смесь угарного и углекислого газов объемом 6,72 л (н. у.) пропустили над раскаленным оксидом меди (II), при этом образовалось 12,8 г порошка меди. Определите массовую долю угарного газа в смеси.
Сохраните или поделитесь с одноклассниками: