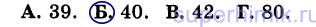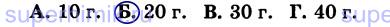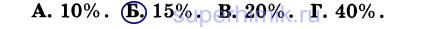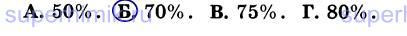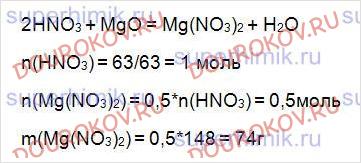Количественные отношения в химии. 3 вариант - cтраницы 84, 85, 86
8. В закрытом сосуде взорвали смесь, состоящую из равных объемов угарного газа (СО) и кислорода. После реакции в сосуде присутствуют вещества:
9. В избытке соляной кислоты растворили 100 г мрамора. После реакции осталось 15 г нерастворившегося вещества. Массовая доля некарбонатных примесей равна:
10. Восстановлением 0,5 моль оксида меди (II) водородом (СuО + Н2 = Сu + Н20) получено 25,6 г металла. Массовая доля выхода продукта реакции от теоретически возможного равна:
ЧАСТЬ Б. Задания со свободным ответом
11. Раствором, содержащим 63 г азотной кислоты, обработали избыток оксида магния. Рассчитайте массу образовавшейся соли.
12. При сжигании 5,6 л (н. у.) ацетилена С2Н2 выделилось 324,8 кДж теплоты. Рассчитайте тепловой эффект реакции, уравнение которой
2С2Н2(г) + 502(г) = 4С02(г) + 2Н20(ж) + Q.
13. 10 г чугуна обработали избытком соляной кислоты. Объем выделившегося водорода составил 3,92 л (н. у.). Рассчитайте массовую долю углерода в чугуне.
Сохраните или поделитесь с одноклассниками: