Тема 28. Расчёты по химическим уравнениям. - cтраницы 134, 135, 136, 137, 138, 139, 140
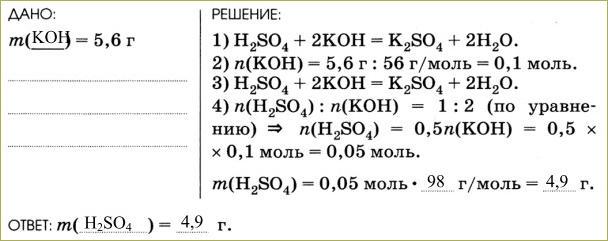
2. Рассмотрим пример. Рассчитайте массу серной кислоты, которая взаимодействует с 5,6 г гидроксида калия. В результате реакции образуется сульфат калия и вода.
2. Рассчитайте массу магния, который может сгореть в кислороде объёмом 33,6 л (н. у.). Схема химической реакции:
3. В реакцию вступили 13 г цинка и соляная кислота. В результате реакции образовались водород и хлорид цинка. Определите объём (н. у.) и число молекул водорода.
4. Навеска 1,12 г железа полностью «растворилась» в растворе сульфата меди (II). Вычислите массу образовавшегося осадка меди. Какое количество вещества сульфата железа (II) получилось при этом?
5. Вычислите массу гидроксида меди (II), который образуется при взаимодействии 200 г 20%-го раствора гидроксида натрия и избытка раствора сульфата меди (II). В результате реакции образуется также сульфат натрия.
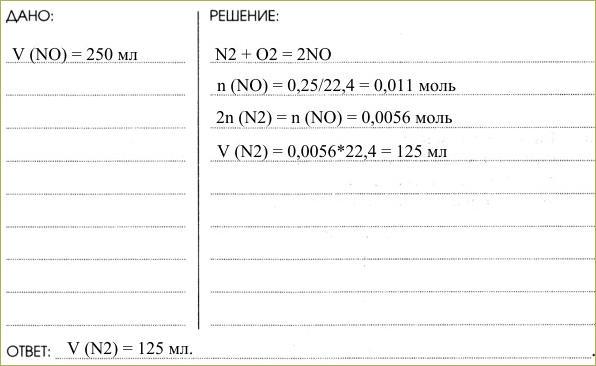
6. Определите объём азота N2, необходимого для взаимодействия с кислородом, если в результате реакции получается 250 мл оксида азота (II).
7. Какой объём воздуха потребуется для взаимодействия 17,5 г лития, содержащего 20% примесей? В результате реакции получается оксид лития.
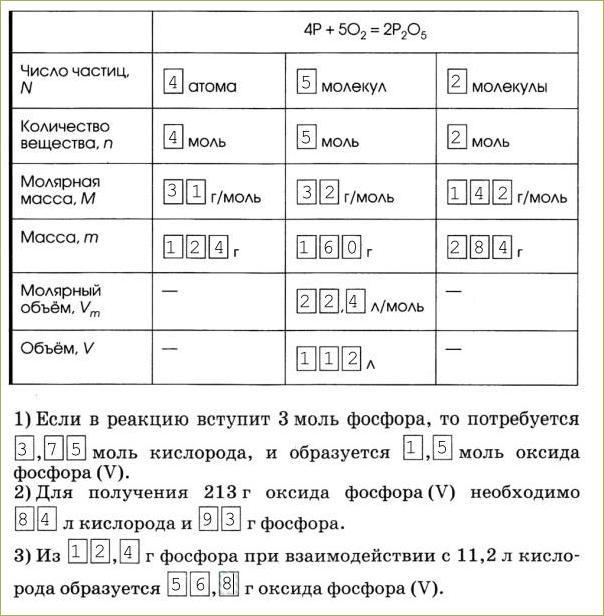
8. Придумайте задачу, при решении которой необходимо использовать следующую схему реакции:
Запишите условие задачи и решите её.
При взаимодействии 2 моль серной кислоты с нитратом свинца, образовался осадок, найти его массу.
Сохраните или поделитесь с одноклассниками: