Уроки 36-37. Кислоты. Химические свойства кислот. Соли. Классификация номенклатура. Способы получения солей - cтраницы 99, 100, 101, 102, 103, 104
1. Кислоты - это сложные вещества, состоящие из кислотных остатков и водорода, который может замещаться на атомы металлов.
2. Подчеркните кислотный остаток в молекулах кислот:
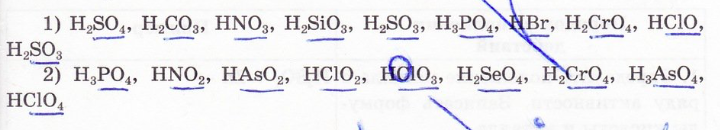
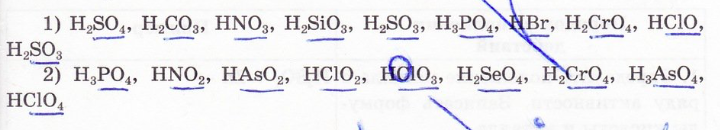
3. Валентность кислотного остатка равна числу атомов водорода, способных замещаться атомами металлов.
Определите валентность кислотных остатков следующих кислот:
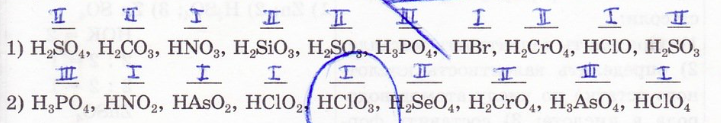
Определите валентность кислотных остатков следующих кислот:
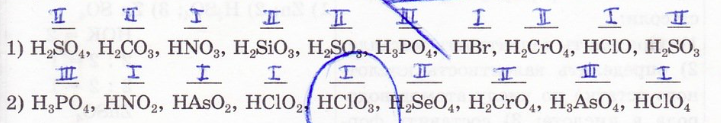
4. Составьте формулы кислот по известным кислотным остаткам:
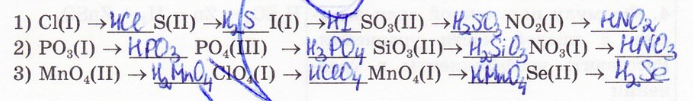
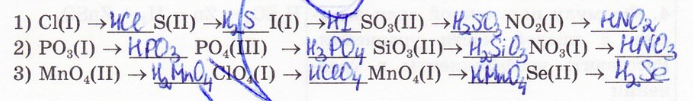
5. Составьте формулы кислот по следующим данным:


6. Составьте уравнения реакций между металлами и растворами кислот (в скобках указана валентность металла в образующейся соли):
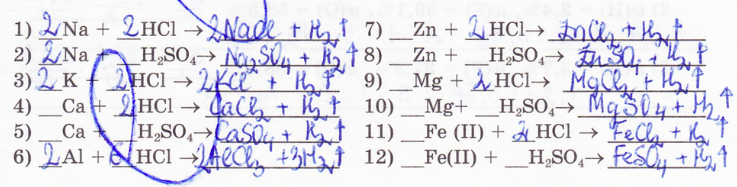
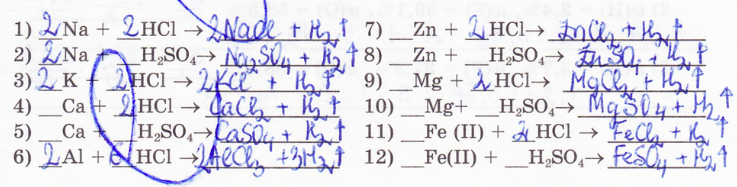
7. Составьте уравнения возможных реакций между металлами и арстворами кислот:


8. Составьте уравнения реакций между кислотами и основными оксидами. Запишите названия образующихся солей.
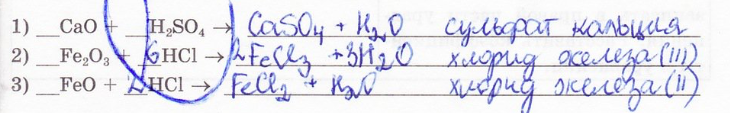
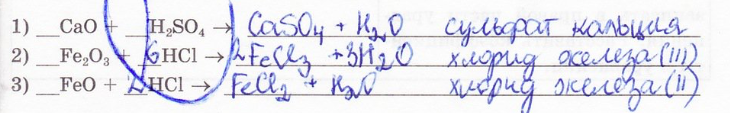
9. Составьте уравнения реакций нейтрализации. Запишие названия образующихся солей.


10. Составьте уравнения реакций по следующим даным:
1) Смесь цинка и оксида цинка растворили в соляной кислоте, а образовавшихся газ пропустили над раскаленным оксидом железа (3).

2) Применяемый как примочка при ушибах ацетат свинца (ядовит) по одному из способов приготовляется дейтсвием уксусной кислоты на оксид свинца (2).

3) При паянии употребляют так называемую травленную кислоту. Приготавливают ее действием цинка на соляную кислоту.

1) Смесь цинка и оксида цинка растворили в соляной кислоте, а образовавшихся газ пропустили над раскаленным оксидом железа (3).

2) Применяемый как примочка при ушибах ацетат свинца (ядовит) по одному из способов приготовляется дейтсвием уксусной кислоты на оксид свинца (2).

3) При паянии употребляют так называемую травленную кислоту. Приготавливают ее действием цинка на соляную кислоту.

11. Задачи:
1) Вычислите массу образующейся соли, если в реакцию вступила серная кислота массой 0,98 г и гидроксид бария.
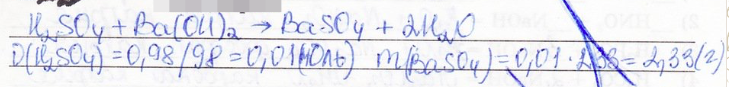
2) Вычислите массу оксида меди (2), способного вступить в реакцию с азотной кислотой массой 12,6 г.

3) Вычислите массу оксида железа (3) способного вступить в реакцию с соляной кислотой массой 1, 825 г.

4) В лаборатории потребовалось нейтрализовать раствор, содержащий серную кислоту. Сначала для нейтрализации был прибавлен раствор гидроксида натрия, а избыток кислоты нейтрализован раствором гидроксида калия. На операцию пошло 4 г гидроксида натрия и 0,56 г гидроксида калия. Определите массу килоты, содержавшейся в растворе.

1) Вычислите массу образующейся соли, если в реакцию вступила серная кислота массой 0,98 г и гидроксид бария.
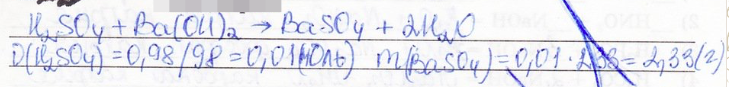
2) Вычислите массу оксида меди (2), способного вступить в реакцию с азотной кислотой массой 12,6 г.

3) Вычислите массу оксида железа (3) способного вступить в реакцию с соляной кислотой массой 1, 825 г.

4) В лаборатории потребовалось нейтрализовать раствор, содержащий серную кислоту. Сначала для нейтрализации был прибавлен раствор гидроксида натрия, а избыток кислоты нейтрализован раствором гидроксида калия. На операцию пошло 4 г гидроксида натрия и 0,56 г гидроксида калия. Определите массу килоты, содержавшейся в растворе.

Урок 34-35. Основания. Классификация. Номенклатура. Получение. Свойства оснований - стр. 94-98Урок 38. Физические и химические свойства солей - стр. 105-108
Сохраните или поделитесь с одноклассниками:

