Урок 34-35. Основания. Классификация. Номенклатура. Получение. Свойства оснований - cтраницы 94, 95, 96, 97, 98
1. Основания - это сложные вещества, в состав которых входят атомы металлов, соединение с одной или несколькими группами атомов ОН.
2. Составьте формулы гидроксидов кальция, цинка, натрия, магния, железа (3)


3. Определите валентность металла по формуле гидроксида:


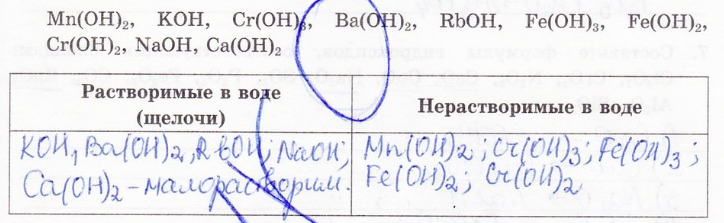
4. Распределите на группы следующие гидроксиды:

5. Определите формулы гидроксидов, имеющих следующий состав (в % по массе):
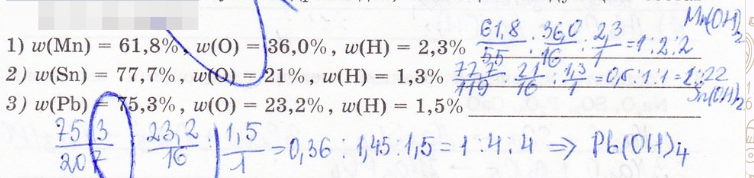
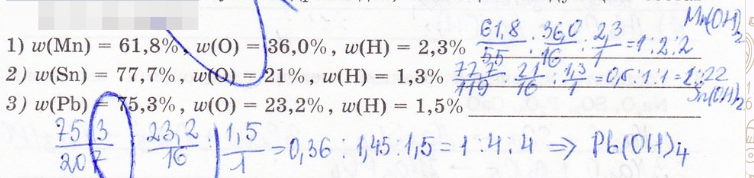
6. Составьте уравнения реакций разложения нерастворимых оснований. Запишите названия образующихся оксидов.


7. Составьте уравнения реакций:
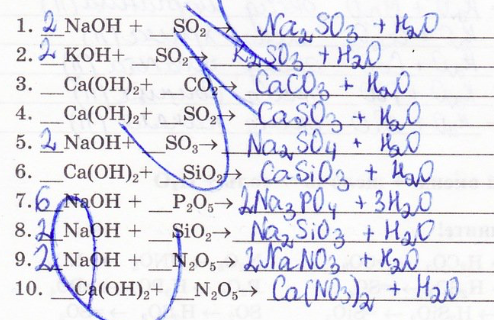
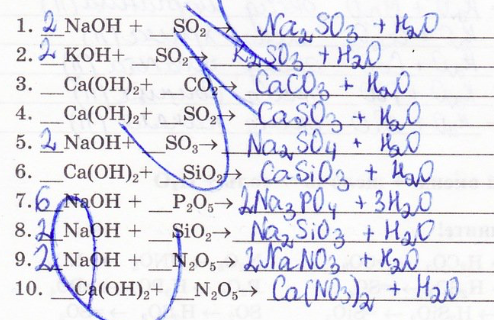
8. Закончить уравнения реакций:
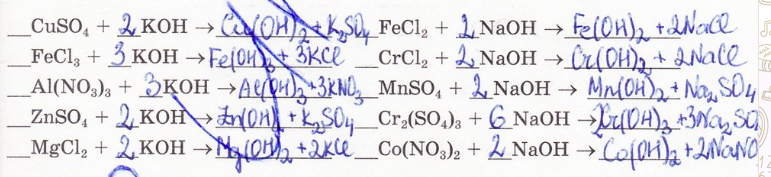
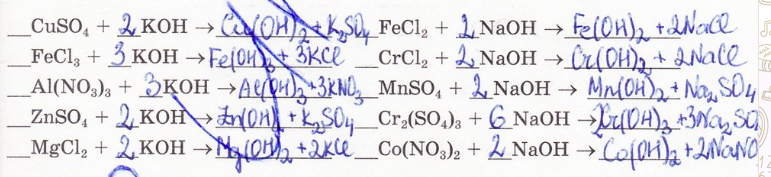
9. Составьте уравнения реакций по следующим данным:
1) При взаимодействии растворов хлорида меди (2) и гидроксида натрия выпал осадок гидроксида меди.
CuCl2+2NaOH->Cu(OH)2+2Na
2) Углекислый газ пропустили через раствор гидроксида кальция ("известковую воду"). Известковая вода помутнела.
СО2+Са(ОН)2->СаСО3+Н2О
3) При нагревании гидроксид меди (2) поменял цвет с голубого на черный.
Cu(OH)2->CuO+H2O
1) При взаимодействии растворов хлорида меди (2) и гидроксида натрия выпал осадок гидроксида меди.
CuCl2+2NaOH->Cu(OH)2+2Na
2) Углекислый газ пропустили через раствор гидроксида кальция ("известковую воду"). Известковая вода помутнела.
СО2+Са(ОН)2->СаСО3+Н2О
3) При нагревании гидроксид меди (2) поменял цвет с голубого на черный.
Cu(OH)2->CuO+H2O
10. Задачи:
1) Вычислите массу гидроксида натрия, необходимого для реакции с 1,6 г сульфата меди (2).
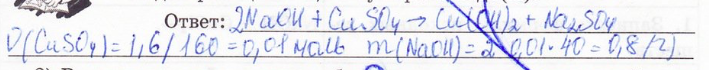
2) Вычислите массу осадка, образовавшегося при взаимодействии гидроксида натрия массой 4 г с раствором хлорида железа (3).

3) Вычислите объем углекислого газа, выступившего в реакцию с избытком известковой воды, если образовался осадок массой 1 г.

4) При разложении гидроксида меди (2) образовался оксид меди массой 8 г. Сколько воды при этом выделилось?

1) Вычислите массу гидроксида натрия, необходимого для реакции с 1,6 г сульфата меди (2).
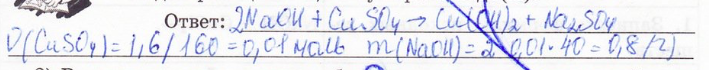
2) Вычислите массу осадка, образовавшегося при взаимодействии гидроксида натрия массой 4 г с раствором хлорида железа (3).

3) Вычислите объем углекислого газа, выступившего в реакцию с избытком известковой воды, если образовался осадок массой 1 г.

4) При разложении гидроксида меди (2) образовался оксид меди массой 8 г. Сколько воды при этом выделилось?

Урок 33. Оксиды. Классификация. Номенклатура. Свойства. Получение. Применение - стр. 92-93Уроки 36-37. Кислоты. Химические свойства кислот. Соли. Классификация номенклатура. Способы получения солей - стр. 99-104
Сохраните или поделитесь с одноклассниками:

