Урок 19-20. Кислород, общая характеристика и нахождение в природе. Получение и свойства кислорода. Оксиды. Применение. Круговорот кислорода в природе - cтраницы 57, 58, 59, 60, 61, 62, 63, 64
1. Прочитайте §18. Заполните таблицу сведениями о кислороде:


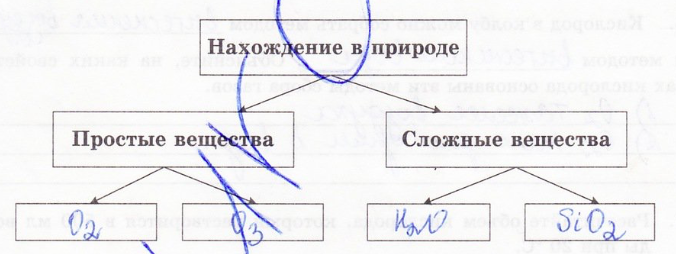
2. Дополните схему, отражающую распространенность кислорода в природе:

3. Вычислите массовую долю кислорода в некоторых веществах:
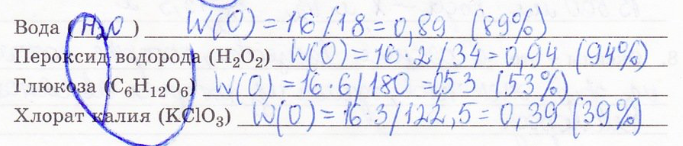
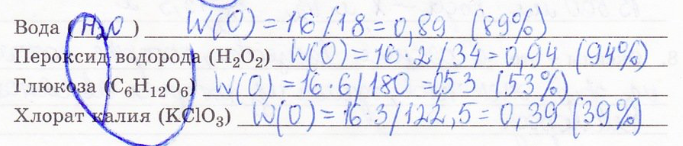
4. Отметьте, в каких случаях речь идет о химическом элементе кислороде, а в каких - о простом веществе кислороде. Обведите цифру правильного ответа: красным - элемент, синим - вещество.
1) Кислород входит в состав воды.
2) Кислород - газ, плохо растворимый в воде.
3) В воздухе содержится приблизительно 21% кислорода.
4) В земной коре содержится приблизительно 47% кислорода.
5) Валентность кислорода равна двум.
6) Рыбы дышат кислородом, растворенным в воде.
7) В промышленности кислород получают из воздуха.
1) Кислород входит в состав воды.
2) Кислород - газ, плохо растворимый в воде.
3) В воздухе содержится приблизительно 21% кислорода.
4) В земной коре содержится приблизительно 47% кислорода.
5) Валентность кислорода равна двум.
6) Рыбы дышат кислородом, растворенным в воде.
7) В промышленности кислород получают из воздуха.
5. Прочитайте §20 и занесите в таблицу сведения о физических свойствах кислорода.


6. Кислород в колбу можно собрать методом вытеснения воздуха и методом вытеснения воды. Объясните, на каких свойствах кислорода основаны эти методы свора газов.
1) О2 тяжелее воздуха.
2) О2 мало растворим в воде.
1) О2 тяжелее воздуха.
2) О2 мало растворим в воде.
7. Рассчитайте объем кислорода, который растворится в 500 мл воды при 20 градусах Цельсия.
В 100 мл воды - 3,1 л кислорода
В 500 мл воды - х л кислорода
х = 15,5 л кислорода.
В 100 мл воды - 3,1 л кислорода
В 500 мл воды - х л кислорода
х = 15,5 л кислорода.
8. Оксиды - это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Из предложенного ряда веществ выпишите оксиды и дайте им названия:
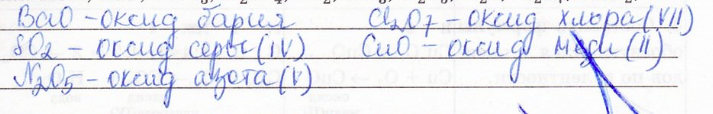
Из предложенного ряда веществ выпишите оксиды и дайте им названия:
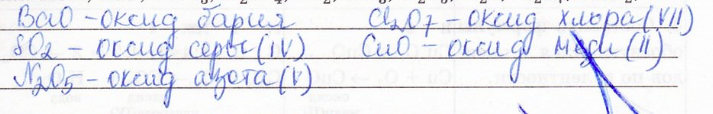
9. Составьте формулы оксидов по следующим данным:


10. Поясните термин "химические свойства веществ".
Свойства, характерные для данного вещества при взаимодействии с другими веществами.
Свойства, характерные для данного вещества при взаимодействии с другими веществами.
11. Какая реакция называется горением?
Горение - химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Горение - химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
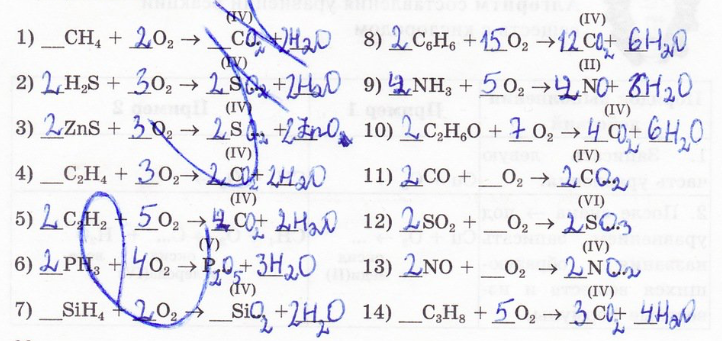
12. Заполните пропуски в схемах реакций:


13. Составьте уравнения реакций горения следующих простых веществ (в скобках указана валентность данного элемента в получаемом оксиде):


14. Составьте уравнения взаимодействия кислорода со сложными веществами:

15. Какие вещества были взяты для реакции, если в результате образовались следующие вещества (в схемах стехиометрические коэффициенты не указаны):


16. Составьте уравнения реакций по следующим данным:
1) При оксилении алюминия кислородом образовался оксид.
4Al+3O2 -> 2Al2O3
2) При взаимодействии меди с кислородом получился оксид меди (II).
2Cu+O2 -> 2CuO
3) При горении этилена образовался углекислый газ.
C2H4+3O2 -> 2CO2+2H2O
4) Бензол сожгли в кислороде. Получился углекислый газ.
2C6H6+15O2 -> 12CO2+6H2O
5) Из железа получили оксид железа (III).
4Fe+3O2 -> 2Fe2O3
6) Уголь сожжен на воздухе.
C+O2 -> CO2
7) Кислород можно получить при разложении перекиси водорода.
2H2O ->t O2+2H2O
8) При сжигании серы получился оксид серы (IV).
S+O2 -> SO2
9) Пирит подвергли обжигу. При этом образовался оксид железа (III) и оксид серы (IV) (с примером и заданием для самостоятельной работы).
4FeS2+11O2 -> 2Fe2O3+8SO2
1) При оксилении алюминия кислородом образовался оксид.
4Al+3O2 -> 2Al2O3
2) При взаимодействии меди с кислородом получился оксид меди (II).
2Cu+O2 -> 2CuO
3) При горении этилена образовался углекислый газ.
C2H4+3O2 -> 2CO2+2H2O
4) Бензол сожгли в кислороде. Получился углекислый газ.
2C6H6+15O2 -> 12CO2+6H2O
5) Из железа получили оксид железа (III).
4Fe+3O2 -> 2Fe2O3
6) Уголь сожжен на воздухе.
C+O2 -> CO2
7) Кислород можно получить при разложении перекиси водорода.
2H2O ->t O2+2H2O
8) При сжигании серы получился оксид серы (IV).
S+O2 -> SO2
9) Пирит подвергли обжигу. При этом образовался оксид железа (III) и оксид серы (IV) (с примером и заданием для самостоятельной работы).
4FeS2+11O2 -> 2Fe2O3+8SO2
17. Составьте уравнения реакций, с помощью которых можно осуществить превращения:
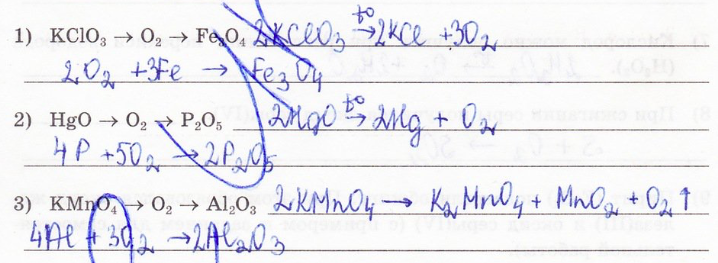
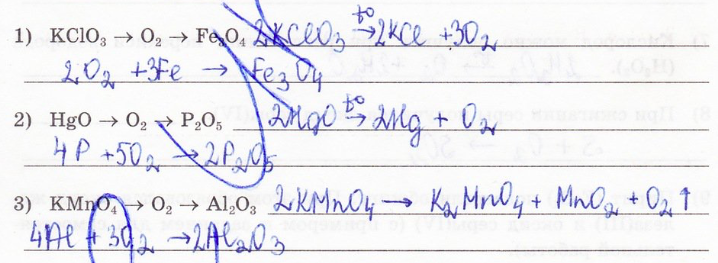
18. Задача. Какое количество вещества кислорода понадобится для полного сгорания 160 г метана? Вычислите массу образующейся при этом воды.


19. Задача. Вычислить массу оксида алюминия, образующегося при окислении 2,7 г алюминия.


20. Задача. Вычислить массу кислорода, требуемого для получения 16 г оксида железа (III) из железа.


21. Задача. Хватит ли 3,2 г кислорода, чтобы полностью окислить железо массой 2,8 г?


Урок 18. Проверь свои знания по теме: Первоначальные химические понятия - стр. 54-56Урок 21. Практическая работа. Получение и свойства кислорода - стр. 64-65
Сохраните или поделитесь с одноклассниками:

