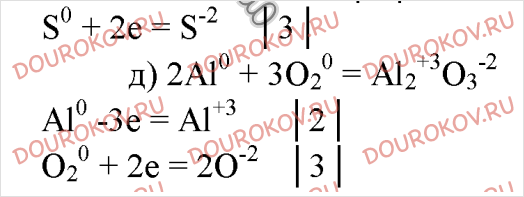Алюминий - cтраницы 164, 165, 166, 167, 168
1. Пользуясь периодической таблицей и на основе представлений о строении атомов, поясните, как изменяются свойства элементов в ряду Na-Mg-Al.
Металлические и основные свойства убывают.
2. Почему алюминий в природе встречается только в соединениях?
Т.к. алюминий сам по себе очень активный металл (так он устойчив к воздействию кислорода и воды из-за наличия оксидной пленки) и в электрохимическом ряду напряжения металлов стоит сразу за самыми активными металлами.
4. Для получения алюминия из AlCl₃ в качестве восстановителя можно использовать кальций. Охарактеризуйте этот процесс и составьте уравнение реакции, покажите переход электронов. Почему эту реакцию нельзя проводить в водном растворе?
5. Составьте уравнения реакций, в которых алюминий восстанавливает: а) галогены; б) железо; в) ионы водорода; г) серу; д) кислород. Покажите переход электронов.
Атомы алюминия не могут быть окислителями.
Окислителями могут быть ионы: 3Ca0+2Al3+ Cl3=3Ca+2 Cl2+2Al0
7. Сколько потребуется алюминия, чтобы при реакции с соляной кислотой получить столько водорода, сколько его выделяется при взаимодействии 1 моль натрия с водой?
8. На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л некоторого газа (н.у.). Вычислите процентный состав сплава, если его общая масса была 10 г.
2. Один из способов получения металлов, например, по уравнению реакции Fe₂O₃+2Al=Al₂O₃+2Fe называют
Алюмотермия
3. Химическую реакцию, уравнение которой 2Al+6HCl=2AlCl₃+3H₂↑, Относят к реакциям
4) замещения
4. Установите соответствие между названием минерала и его формулой.
1) боксит - Al₂O₃·nH₂O
2) корунд – Al₂O₃
3) каолинит - Al₂O₃·2SiO₂·2H₂O
4) полевой шпат - K₂O·Al₂O₃·6SiO₂
Сохраните или поделитесь с одноклассниками: