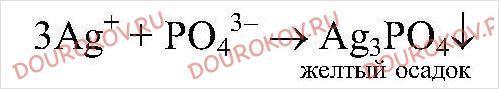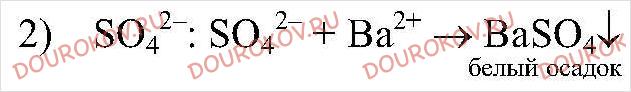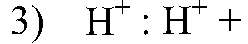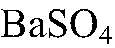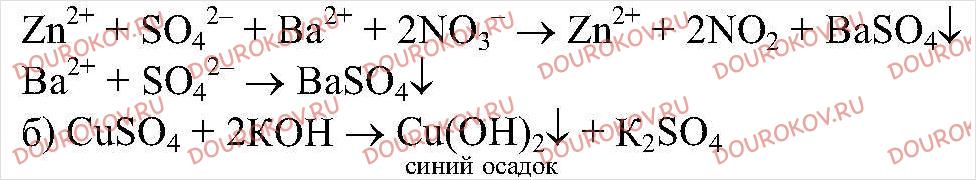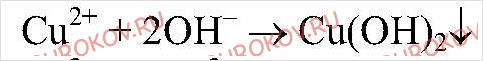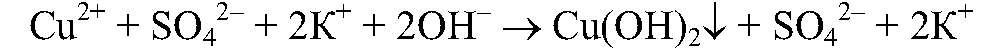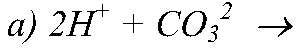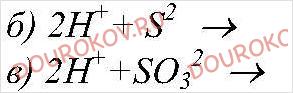Реакции ионного обмена - cтраницы 33, 34, 35, 36, 37, 38
1. Какие реакции называют качественными?
Те реакции, с помощью которых определяют наличие того или иного иона в растворе.
2. Даны растворы, содержащие ионы Ag+, SO42-,H+,I-. С помощью каких реакций можно определить эти растворы? Напишите уравнения соответствующих реакций.
Ответ:
индикаторы
изменение окраски
3. Даны растворы: а) сульфата цинка и нитрата бария; б) сульфата меди (II) и гидроксида калия; в) сульфата цинка, хлорида магния и орто-фосфата натрия; г) хлорида железа (III) и сульфата магния. При сливании каких растворов реакции обмена пойдут до конца и почему?
Ответ:
реакция пойдет до конца, т.к.
выпадает в осадок.
Реакция идет до конца, т.к.
выпадает в осадок.
5. В раствор, содержащий 40 г сульфата меди (II), поместили железные опилки. Какие вещества образуются в результате реакции и какова их масса?
Решение
Запишем уравнение реакции:
Fe+CuSO4=FeSO4+Cu
теперь найдем, сколько моль соли вступит в реакцию
M(CuSO4)=64+32+16*4=160г/моль
n(CuSO4)=m/M=40г/160г/моль=0,25 моль
из уравнения видно, что 1 моль соли соответствует 1молю образующейся меди 1 молю сульфата железа, следовательно
n(FeSO4)=n(Cu)=0,25 моль
теперь найдем массы продуктов реакции
m(FeSO4)=0,25 моль*152г/моль=38г
m(Cu)=0,25 моль*64г/моль=16 г
6. К 20 г раствора, содержащего 5% сульфат меди, добавили гидроксид натрия. Вычислите массу образовавшегося осадка.
Решение
1. Составляем уравнение образования осадка
CuSO4+2NaOH=Cu(OH)2+Na2SO4
осадок Cu(OH)2
2. Находим сулфат меди (II) в растворе:
m(CuSO4в-ва)= m (р-ра)*w/100%=20*5/100=1г
3. Находим количество сульфата меди:
n( CuSO4)=m (CuSO4)/M (CuSO4)=1г/160г/моль=0,00625 моль
4. n( CuSO4)=n (Cu (OH)2)
5. Находим массу осадка
m (Cu (OH)2)=n (Cu (OH)2)*М (Cu (OH)2)=0,00625моль*98г/моль=0,6125г
Ответ: m (Cu (OH)2)= 0,6125 г
1. 1)
2. 1)
3. 2)
Сохраните или поделитесь с одноклассниками: