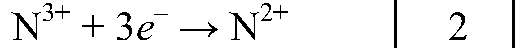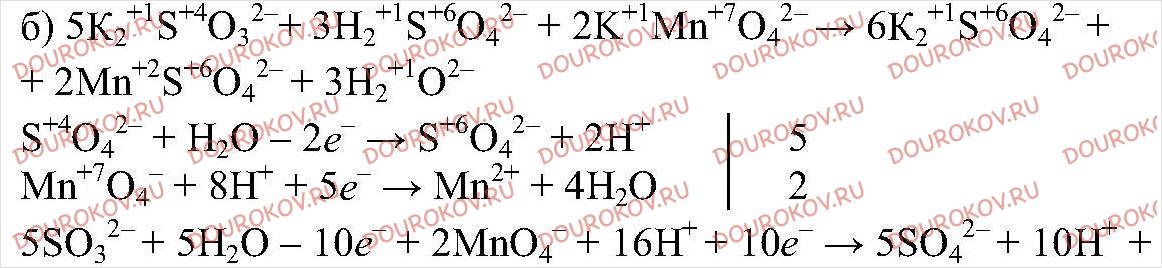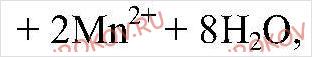Окислительно-восстановительные реакции - cтраницы 4, 5, 6, 7, 8, 9
1. Определите степени окисления элементов в следующих соединениях:
Li+12O-2, Na+12O-12, H+12S-2, Li+1H-1, P+52O-25, K+12Cr+62O-27.
2. Докажите, что реакция
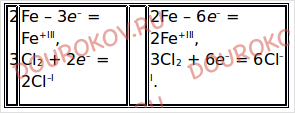
2Fe + 3Cl2 = 2FeCl3 является окислительно-восстановительной. Укажите окислитель и восстановитель.
Fe0 – 3e– = Fe+III восстановитель
Cl02 + 2e– = 2Cl–I окислитель
3. Заполните таблицу, приведя по два примера реакций соединения и разложения, которые не являются окислительно-восстановительными. Обсудите таблицу с соседом о парте. Проверьте друг у друга заполненную таблицу.
4. Даны схемы реакций.
Zn+Cl2=ZnCl2
Zn+2HCl=ZnCl2+H2
Поставьте над знаками соответствующих химических элементов степени окисления, покажите переход электронов и расставьте коэффициенты.
Zn0+Cl02=Zn+2Cl-12
Zn0 – 2e– = Zn +II восстановитель, окисление
Cl02 + 2e– = 2Cl–I окислитель, восстановление
Zn0+2H+1Cl-1=Zn+2Cl-12+H02
Zn0 – 2e– = Zn +II восстановитель, окисление
2H+ + 2e– = H20 окислитель, восстановление
5. Даны схемы окислительно-восстановительных реакций.
А) CuS + HNO3 = Cu(NO3)2 + S + NO + H2O
Б) K2SO3+ H2SO4+KMnO4 = K2SO4 + MnSO4 + H2O
Составьте уравнения этих реакций, пользуясь алгоритмом, приведенном в параграфе.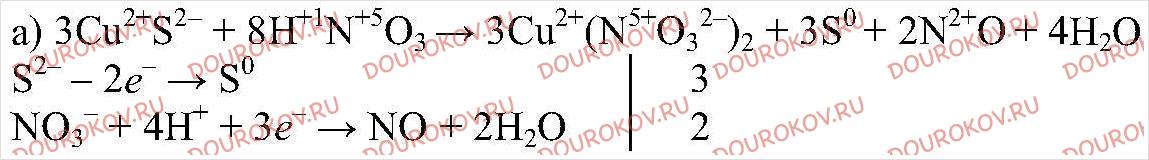
6. В схеме реакции HNO3 → H2O + NO2 + Q. Расставьте коэффициенты методом электронного баланса.
4HN⁺⁵O₃ = 2H₂O + 4N⁺⁴O₂ + O₂°
N⁺⁵ + 1e⁻ = N⁺⁴ /4 окислитель
2O⁻² - 4e⁻ = O₂° /1 восстановитель
1. 2)
2. 1)б
2) д
3) а
4) г
Сохраните или поделитесь с одноклассниками: