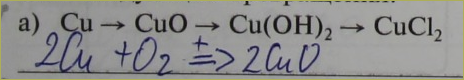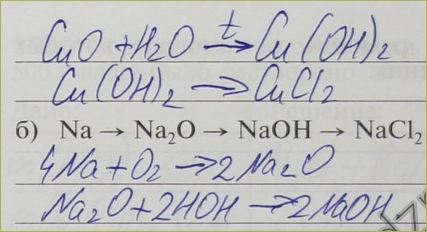Обобщение сведений о важнейших классах неорганических соединений - cтраницы 49, 50, 51, 52, 53, 54, 55, 56, 57, 58
127. Напишите формулы оксидов следующих элементов:
а) натрия Na2O
б) железа FeO, Fe2O3
в) водорода H2O
г) цинка ZnO
128. Напишите уравнения реакций получения следующих оксидов:
а) оксида водорода 2H2 + O2 = 2H2O
б) оксида калия 4К + О2 = 2Н2О
в) оксида меди (II) 2Сu + O2 = 2CuO
г) оксида алюминия 4Al + 3O2 = 2Al2O3
129. Вычислите массовые доли кислорода (в %) в следующих оксидах:
а) СаО ω(0) = 16/56 · 100 % = 28,6 %
б) Na2O ω(0) = 16/62 · 100 % = 25,8 %
в) P2O5 ω(0) = 16/142 · 100 % = 56,3 %
г) Fe2O3 ω(0) = 3 · 16/160 · 100 % = 30 %
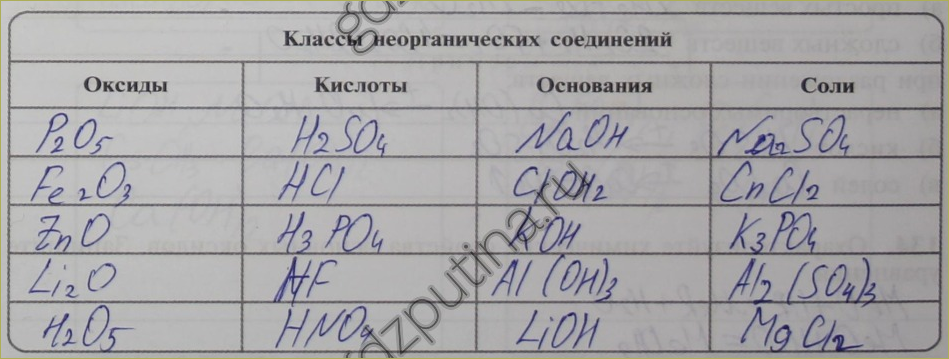
130. Заполните таблицу «Важнейшие классы неорганических соединений». Впишите химические формулы веществ.
132. Подчеркните правильный ответ.
1. В каком из предложенных вариантов приведены формулы только кислотных оксидов?
б) SO2, CO2, P2O3
2. В каком из предложенных вариантов приведены формулы только основных оксидов?
в) CaO, K2O, Li2O
133. Запишите уравнения химических реакций получения оксидов
при горении:
а) простых веществ 2Н2 + О2 = 2Н2О
б) сложных веществ 2С2Н2 + 5О2 = 4СО2 + 2Н2О
при разложении сложных веществ:
134. Охарактеризуйте химические свойства основных оксидов. Запишите уравнения.
МеО + HR = MeR + H2O
MeO + H2O = MeOH9
135. Из приведенного перечня выпишите формулы основных и кислотных оксидов.
K2CO3, Li2O, H2S, Cr2O3, CH4, NaNO3, CO2, Ca(NO3)2, SiO2, Na2S.
Основные оксиды: Li2O2, Cr2O3
Кислотные оксиды: CO2, SiO2
137. Запишите определение.
Основание – это сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими группами ОН.
138. 1. Заполните схему «Классификация оснований».
2. На чем основана классификация оснований?
Есть растворимые и нерастворимые в воде основания
139. Напишите уравнения химических реакций, отражающих способы получения оснований.
1. Щелочи:
а) активный металл + вода 2Li + 2 HOH → 2LiOH + H2↑
б) оксид активного металла + вода CaO + HOH → Ca(OH)2
2. Нерастворимые основания:
Соль (р-р) + щелочь (р-р) FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
140. Допишите уравнения и укажите тип каждой химической реакции.
а) 2K + 2H2O → 2HOH + H3↑
б) FeCl3 + 3KOH → Fe(OH)3 + 3KCl
в) Ca + H2O → Ca(OH)2 + H2↑
г) Cu(NO3)2 + NaOH →
141. Охарактеризуйте химические свойства щелочей и нерастворимых оснований, напишите уравнения соответствующих химических реакций.
а) Щелочи: MeOH + KR =H2O + MeR
б) Нерастворимые основания: MeOH + KH = H2O – MeK
142. Из приведенного перечня выпишите формулы оснований.
Na2CO3, Fe(OH)3, CaO, SO3, Cu(OH)2, HCl, KOH, CH4, CuO, Al(OH)3, SiO2, CO2, Ca(OH)2, LiOH, Ba(OH)2.
Щелочи: LiOH, KOH, Ba(OH)2, Ca(OH)2
Нерастворимые основания: Cu(OH)2, Fe(OH)3, Al(OH)3, Na2CO3, CaO
144. Какую массу серной кислоты необходимо взять для нейтрализации раствора, содержащего 40 г гидроксида калия?
146. Составьте формулы оснований перечисленных металлов: натрия, бария, железа (II) и железа (III).
NaOH, Ba(OH2), Fe(OH)3, Fe(OH)2
148. Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
а) Ba → BaO → Ba(OH)2 → BaCl2
2Ba + O2 = 2BaO
BaO + HOH = Ba(OH)2
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
б) CaO → Ca(OH)2 → CaSO4
CaO + H2O = Ca(OH)2↓
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
149. Какие реакции называют реакциями нейтрализации?
Реакции между кислотой и основанием, в результате которой образовалась соль и вода
Приведите примеры реакций нейтрализации
а) 2KOH + H2SO4 = K2SO4 + 2H2O
б) NaOH + HCl = NaCl + H2O
в) 3LiOH + H3PO4 = Li3PO4 + 3H2O
150. Какое вещество образуется при взаимодействии оксида натрия с водой? Напишите уравнение реакции.
Na2O + H2O = 2NaOH – гидроксид натрия
151. Определите массу полученного вещества, если известно, что в реакцию вступило 0,5 моль оксида кальция и 200 г воды. Какое вещество взято в избытке? Какова масса этого вещества не вступит в реакцию?
152. Определите массовые доли веществ в растворе, если известно, что в 500 г воды было растворено 19 г гидроксида бария.
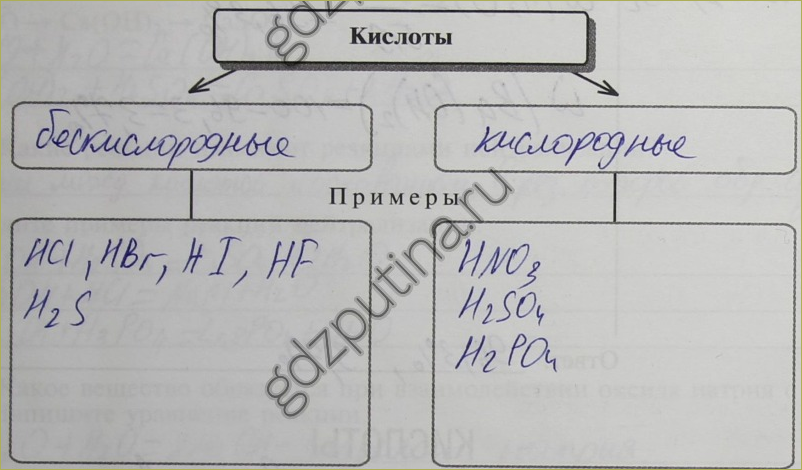
153. Какие вещества называют кислотами?
Вещества, состоящие из кислотного остатка и водорода
156. 1. Заполните схему «Классификация кислот».
2. На чем может быть основана классификация кислот?
На том, что кислоты делятся на кислородные и бескислородные
158. Приведите примеры основных способов получения кислотю Напишите по два уравнения химических реакций для каждого способа получения.
160. Опишите химические свойства азотной кислоты, напишите уравнения соответствующих химических реакций.
161. Распределите металлы K, Hg, Ni, Al, Fe, Pt, Zn, Pb, Na, Cu, Sn, Ag, Mg, Au по двум группам:
1) водород из кислот вытесняют:
K, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb
2) водород из кислот не вытесняют:
Cu, Hg, Ag, Pt, Au
162. Допишите уравнения химических реакций.
а) HCl + Mg → MgCl2 + H2↑
б) H2SO4 + Zn → H2 + ZnSO4
в) Pb(NO3)2 + H2SO4 →
г) HCl + Al → 2AlCl3 + 3H2
д) ZnO + HCl → ZnCl2 + H2O
163. Определите, какое количество вещества оксида кальция прореагировало с серной кислотой массой 14,7 г. Какая масса соли образовалась?
164. Вычислите массу и количество вещества образовавшейся соли, если известно, что в реакцию вступило 7,3 г соляной кислоты и 0,5 моль оксида меди (II).
Сохраните или поделитесь с одноклассниками: