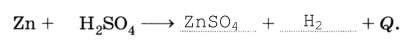Тема 31. Реакции замещения. - cтраницы 149, 150, 151, 152
- вступают в реакцию два вещества – простые и сложные;
- образуются в результате реакции также два вещества – новое простое и новое сложное.
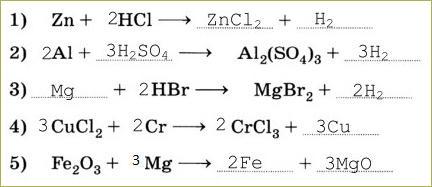
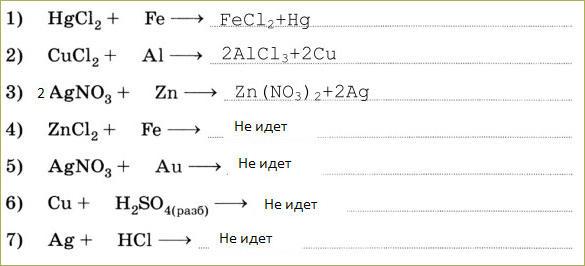
2. Два правила ряда активности металлов:
- металлы, стоящие в ряду активности до H2, вытесняют его из растворов кислот;
- металлы, стоящие в ряду активности до металла соли, вытесняют его из растворов солей.
4. Допишите уравнение реакции
Дайте характеристику записанной реакции по следующим признакам:- число и состав исходных веществ и продуктов реакции – замещение;
- тепловой эффект – экзотермическая;
- направление протекания – необратимая;
- участие катализатора – некаталитическая.
5. 39 г технического цинка, содержащего 20% примесей, растворили в избытке соляной кислоты. Найдите объём полученного водорода (н. у.) и количество вещества соли.
6. Железо массой 1,12 г полностью прореагировало с раствором сульфата меди (II). Найдите массу образовавшегося осадка меди. Какое количество вещества сульфата железа (III) при этом получилось?
7. Придумайте рисунки «Взаимодействие различных металлов с соляной кислотой» и «Взаимодействие различных кислот с цинком», иллюстрирующие зависимость скорости протекания реакций от природы металла и кислоты.
Сохраните или поделитесь с одноклассниками: