Тема 4. Химические формулы. Относительные атомная и молекулярная массы. - cтраницы 20, 21, 22, 23, 24
1.
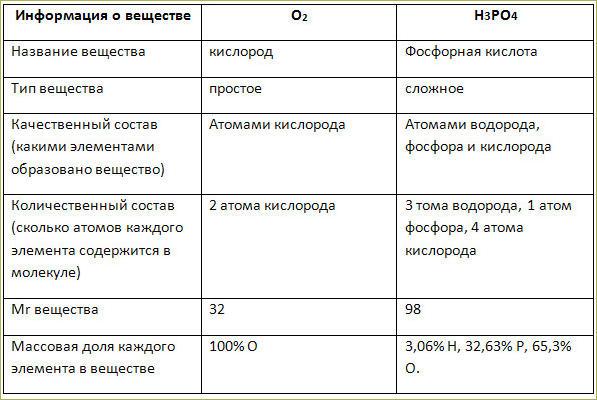
2. Ar элемента показывает, во сколько раз масса его атома больше 1/12 массы атома углерода.
Она указана в таблице Д. И. Менделеева, например:

Ar (Н) = 1
Ar (О) = 16
Ar (N) = 14
Ar (Fe) = 56
Ar (Сu) = 64
Ar (Cl) = 35,5
3. Mr вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода.
Mr равна сумме Ar элементов с учётом их индексов.
Mr (Н₂О) = 2*1+16=18
Mr (Н₂ SO₄) =2*1+32+4*16=98
Mr (CO₂) = 1*12+2*16=44
Mr [Ca₃(PO₄)] = 3*40+2*31+8*16=310
1. Установите соответствие между формулой вещества и составом молекулы вещества.

А – 4;
Б – 6;
В – 2;
Г – 5.
2. Разделите указанные вещества на простые и сложные:
N₂, NO, O₃, AlCl₃, Na₂So₄, FeCl₂, Ca, Cl₂, KMnO₄, P₄.

3. Исправьте неверно вычисленные значения относительных молекулярных масс для некоторых из приведённых формул.
3) Mr (AlCl₃) = 133,5
6) Mr (Al₂(SO₄)₃) = 342
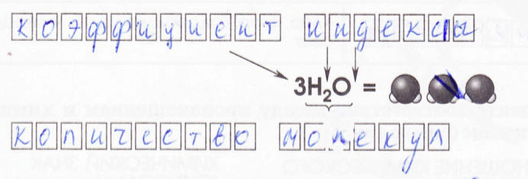
4. Установите соответствие между записью и тем, что она обозначает.

А – 4;
Б – 3;
В – 1;
Г – 2.
5. Молекула сахарозы состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. Напишите её формулу и рассчитайте относительную молекулярную массу.
6. Сравните по составу молекулы Н₂О и Н₂О₂.
Сходство: по качественному составу – атомы Н и О;
Различие: по количественному составу – в молекуле воды на один атом кислорода меньше.
7. Определите массовые доли водорода и кислорода в пероксиде водорода Н₂О₂.

8. Запишите формулы вещества, зная их произношение. Рассчитайте Mr.
1) N₂O, Mr (N₂O) = 2*14+16=44
2) H₂SiO₃, Mr (H₂SiO₃) = 2*1+28+3*16=78
3) CuSO₄, Mr (CuSO₄) = 64+32+4*16=160
9. Придумайте и решите задачу на расчёт массовой доли химического элемента в составе сложного вещества, состоящего из двух элементов.
Найти массовую долю каждого элемента в Na₂O.

Сохраните или поделитесь с одноклассниками: