Уроки 49-52. Электроотрицательность химических элементов. Ковалентная неполярная и полярная связь. Ионная связь - cтраницы 127, 128, 129
1. Электроотрицательность - это свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях.
2. Расположите элементы: фосфор, магний, бор, цезий, кислород, кремний, калий, углерод, фтор, водород, литий, серу и алюминий - в порядке увеличения значения электроотрицательности.
Cs->K->Li->Mg->Al->Si->B->H->P->C->S->O->F
Cs->K->Li->Mg->Al->Si->B->H->P->C->S->O->F
3. Как связана электроотрицательность с атомным радиусом?
Чем меньше радиус атома, тем больше его электроотрицательность.
Чем меньше радиус атома, тем больше его электроотрицательность.
4. Подчеркните схему электронного строения наиболее электроотрицательного из приведенных химических элементов.
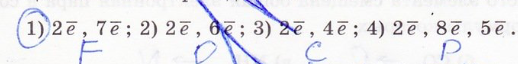
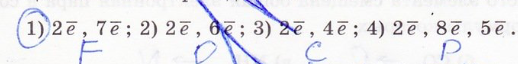
5. Ковалентная связь - это связь, которая образуется при взаимодействии атомов с образованием общей электр.р.
Неполярной называют ковалентную связь, которая образуется между атомами с одинаковой электроотрицательностью.
Полярной называют ковалентную связь, которая образуется между атомами, которых электроотрицательность отличается, не незначительно.
Неполярной называют ковалентную связь, которая образуется между атомами с одинаковой электроотрицательностью.
Полярной называют ковалентную связь, которая образуется между атомами, которых электроотрицательность отличается, не незначительно.
6. Какие электроны называют "валентными"? Почему?
Валентные электроны - электроны, находящиеся на внешней, или валентной оболочке атома.
Валентные электроны - электроны, находящиеся на внешней, или валентной оболочке атома.
7. Определите число валентных электронов в атомах.
а) натрия 1
б) магния 2
в) кислорода 6
г) фосфора 5
д) хлора 7
е) алюминия 3
ж) кальция 2
з) бора 3
а) натрия 1
б) магния 2
в) кислорода 6
г) фосфора 5
д) хлора 7
е) алюминия 3
ж) кальция 2
з) бора 3
8. Ионная связь - это химическая связь, возникающая между ионами в результате действия электростатических сил притяжения.
9. Приведите примеры соединений, где один химический элемент участвует в образовании различных видов химической связи: ковалентной полярной, неполярной, ионной.
Cl2 - ковалентно неполярная, НCl - полярная, NaСl - ионная.
Cl2 - ковалентно неполярная, НCl - полярная, NaСl - ионная.
10. Приведите примеры молекул, в которых связь между двумя атомами осуществляется:
а) одной парой электронов Н2;
б) двумя парами электронов Н2О;
в) тремя парами электронов NН3.
а) одной парой электронов Н2;
б) двумя парами электронов Н2О;
в) тремя парами электронов NН3.
11. Изобразите электронные формулы молекул:


12. К атомам какого элемента смещена общая электронная пара в соединениях, формулы которых
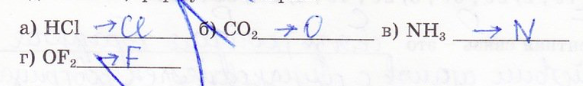
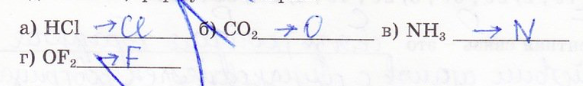
13. В молекулах какого соединения полярность связи наименьшая (подчеркните), наибольшая (обведите в кружок):


14. Атом серы образует химические связи с калием, водородом, бромом и углеродом. Какие связи наиболее и наименьшее полярны? Укажите, в сторону какого атома происходит смещение электронной плотности в каждом случае.


15. Распределите на группы следующие вещества в соответствии с типом химической связи в этих соединениях.


16. Составьте схему образования ионной связи для следующих соединений:
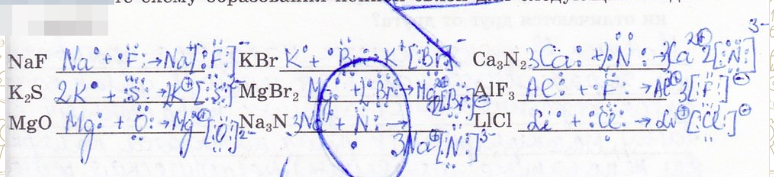
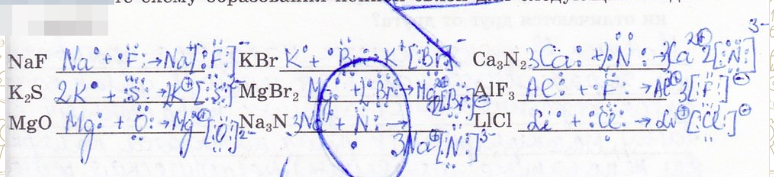
Урок 48. Значение Периодического закона. Жизнь и деятельность Д.И.Менделеева - стр. 125-126Урок 53. Кристаллические решетки - стр. 130-131
Сохраните или поделитесь с одноклассниками:

