Уроки 45-47. Строение атомов. Состав атомных ядер. Изотопы. Строение электронных оболочек атомов первых 20 химических элементов Периодической системы. Современная формулировка Периодического закона. Периодическое изменение свойств химических элементов - cтраницы 120, 121, 122, 123, 124
1. Химический элемент - это совокупность атомов с одинаковым зарядом ядра и числом протонов.
2. Физический смысл порядкового номера элементов.
Заряд ядра численно совпадает с порядковым номером элемента, а также с количеством протонов и электронов.
Заряд ядра численно совпадает с порядковым номером элемента, а также с количеством протонов и электронов.
3. Найдите в Периодической таблице: а) водород, б) гелий, в) азот, г) хлор, д) олово, е) цирконий. Сколько протонов с ядрах атомов этих элементов? Каковы заряды их ядер? Сколько в этих атомов электронов?
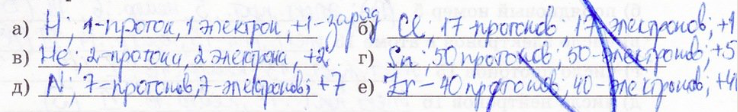
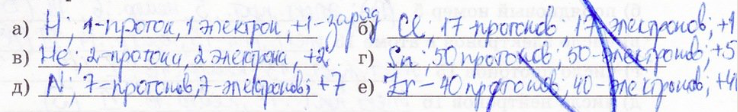
4. В состав атомных ядер кроме протонов входят нейтроны. Для вычисления числа нейтронов нужно из атомной массы (Аr) вычесть порядковый номер атома.
Определите число нейтронов в ядрах атомов изотопов водорода, изотопов хлора, калия.
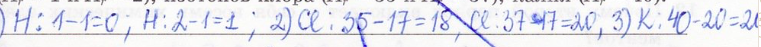
Определите число нейтронов в ядрах атомов изотопов водорода, изотопов хлора, калия.
5. Изотопы - это разновидность атомов одного и того же химического жлемента, имеющие одинаковое число протонов, но разное число нейтронов в ядре.
6. Определите массовое число (относительную атомную массу) одного из изотопов меди, в ядре которого находится 36 нейтронов.
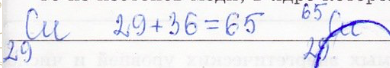
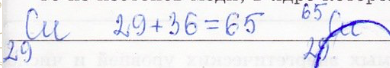
7. Определите порядковый номер элемента 41Э, если в его ядре находится 20 нейтронов.
41-20=21.
4121Sе
41-20=21.
4121Sе
8. Массовое число изотопа элемента равно 130, а в атоме 54 электрона. Число протонов и нейтронов в ядре атома соответственно равно
протоны=электроны=54
нейтроны: 130-54=76
13054Хе
протоны=электроны=54
нейтроны: 130-54=76
13054Хе
9. Хлор представляет смесь изотопов с массовыми числами 35 и 37. Вычислите долю (в %) атомов 35С1 в природной смеси изотопов, если средняя относительная атомная масса элемента хлора равна 35,485.


10. Определите состав атома (число электронов, протонов, нейтронов) и высшую валентность по следующим данным:


11. Почему первый период состоит только из двух химических элементов?
Потому что только водород и гелий имеют один энергетический уровень.
Потому что только водород и гелий имеют один энергетический уровень.
12. Почему второй период включает в себя восемь химических элементов?
Потому что только эти элементы два энергетических уровня.
Потому что только эти элементы два энергетических уровня.
13. Что показывает номер периода?
Количество энергетических уровней.
Количество энергетических уровней.
14. Определите число заполняемых энергетических уровней и число электронов на внешнем уровне атомов:
а) натрия 3, 1
б) серы 3, 5.
в) брома 4, 7.
г) теллура 5, 6.
д) висмута 6, 5.
е) таллия 6, 3.
а) натрия 3, 1
б) серы 3, 5.
в) брома 4, 7.
г) теллура 5, 6.
д) висмута 6, 5.
е) таллия 6, 3.
15. Как определить число электронов во внешнем уровне атомов химических элементов главных подгрупп?
Равно номеру группы.
Равно номеру группы.
16. Определите число валентных электронов в атомах:
а) натрия 1
б) магния 2
в) кислорода 6
г) фосфора 5
д) хлора 7
е) селена 6
а) натрия 1
б) магния 2
в) кислорода 6
г) фосфора 5
д) хлора 7
е) селена 6
17. Составьте схему распределения электронов по энергетическим уровням для следующих элементов:


18. Какому элементу принадлежит схема распределения электронов по энергетическим уровням:


19. По электронной схеме строения атома определите химический знак элемента, формулу его высшего оксида и соединения с водородом:
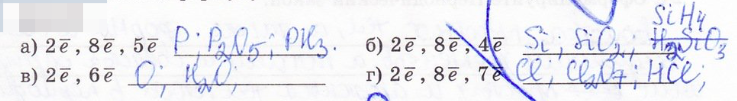
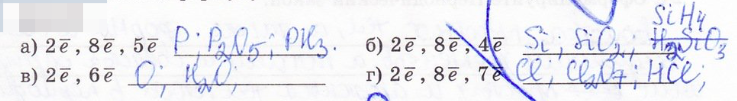
20. Составьте формулы высшего оксида и летучего водородного соединения для:
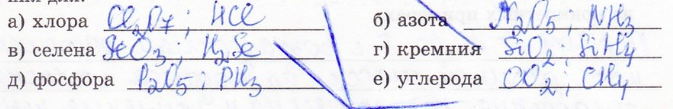
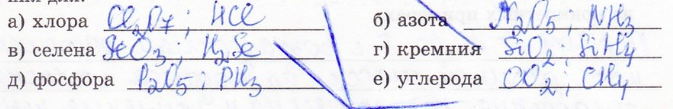
21. Расположите химические элементы в порядке увеличения атомного радиуса. ПРиведите последовательность цифр.
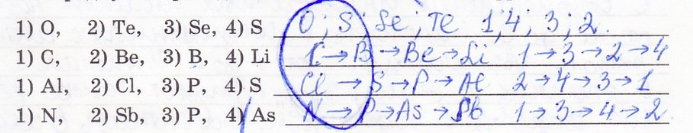
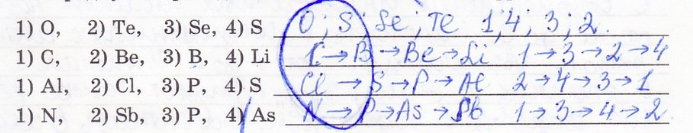
22. Определите формулы и характер оксида и гидроксида химического элемента по положению в Периодической системе образующего их элемента:


23. Расположите химические элементы в порядке уменьшения энергии ионизации (увеличения способности отдавать электроны):


24. Сформулируйте Периодический закон.
Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса.
Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса.
25. В чем проявляется сущность явления периодичности? Покажите на конкретных примерах.


Уроки 43-44. Периодический закон Д.И.Менделеева. Периодическая таблица. Группы, периоды - стр. 119-120Урок 48. Значение Периодического закона. Жизнь и деятельность Д.И.Менделеева - стр. 125-126
Сохраните или поделитесь с одноклассниками:

