Уроки 24-26. Водород, его общая характеристика и нахождение в природе. Получение водорода и его свойства. Применение водорода - cтраницы 72, 73, 74, 75, 76, 77
1. Подчеркните одной чертой предложения, в которых речь идет о водороде как о простом веществе, двумя чертами - те, в которых говорится о водороде как о химическом элементе.
Простое вещество: а) Водород - самый легкий газ. в) Водород - топливо будущего. д) Водород плохо растворим в воде.
Химический элемент: б) Водород входит в состав природного газа - метана. г) Вещества, входящие в состав топлива - бензин и керосин - содержат водород. е) Водород входит в состав воды.
Простое вещество: а) Водород - самый легкий газ. в) Водород - топливо будущего. д) Водород плохо растворим в воде.
Химический элемент: б) Водород входит в состав природного газа - метана. г) Вещества, входящие в состав топлива - бензин и керосин - содержат водород. е) Водород входит в состав воды.
2. По §27 (§3, гл. III), представьте материал о физических свойствах водорода в виде таблицы.


3. Водород получают различными способами. Охарактеризуйте некоторые из них.
1) Разложение воды водород получают в соответствии со следующим уравнением реакции: 2Н2О -> 2Н2+О2.
Эта реакция протекает при условии электрического тока.
По тепловому эффекту эта реакция эндотермическая.
2) Водород в лаборатории получают, как правило, взаимодейтсвием металлов с кислотами в соответствии с уравнением реакции Zn+2HCl -> ZnCl2+H2|.
При этой реакции атомы металла замещают водород в кислоте.
Составьте уравнения реакций:
Са+2HCl -> CaCl2+H2
2Na+2HCl -> 2NaCl+H2
Mg+2HCl -> MgCl2+H2
1) Разложение воды водород получают в соответствии со следующим уравнением реакции: 2Н2О -> 2Н2+О2.
Эта реакция протекает при условии электрического тока.
По тепловому эффекту эта реакция эндотермическая.
2) Водород в лаборатории получают, как правило, взаимодейтсвием металлов с кислотами в соответствии с уравнением реакции Zn+2HCl -> ZnCl2+H2|.
При этой реакции атомы металла замещают водород в кислоте.
Составьте уравнения реакций:
Са+2HCl -> CaCl2+H2
2Na+2HCl -> 2NaCl+H2
Mg+2HCl -> MgCl2+H2
4. Водород выделяется при взаимодействии активных металлов с кислотой.
В соответствии с уравнением реакции 2Na+2H2O -> 2NaOH+H2.
Из воды вытесняется одно валентная группа ОН-гидроксидная, которая соединяется с металлом. Образующиеся соединения относятся к основаниям (щелочам).
Составьте уравнения реакций:
2К+2Н2О - 2КОН+Н2
Ва+2Н2О - Ва(ОН)2+Н2О
В соответствии с уравнением реакции 2Na+2H2O -> 2NaOH+H2.
Из воды вытесняется одно валентная группа ОН-гидроксидная, которая соединяется с металлом. Образующиеся соединения относятся к основаниям (щелочам).
Составьте уравнения реакций:
2К+2Н2О - 2КОН+Н2
Ва+2Н2О - Ва(ОН)2+Н2О
5. Прочтите §27 и заполните таблицу, отражающую химические свойства водорода.


6. Закончите уравнения реакций.


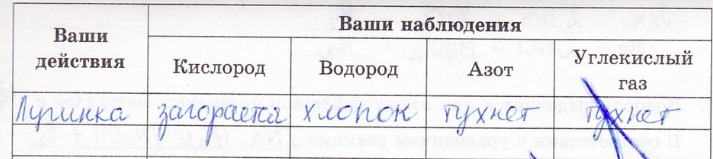
7. Даны четыре сосуда с газами: кислородом, водородом, углекислым газом и азотом. Как отличить эти вещества друг от друга?

8. Запишите уравнения реакций, соответствующие цепочке превращения веществ:
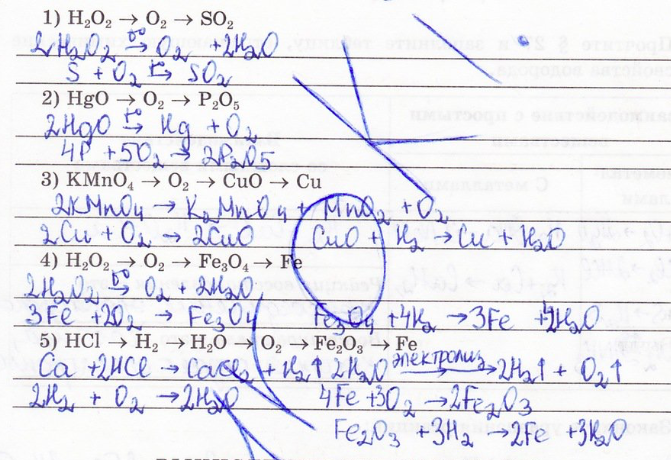
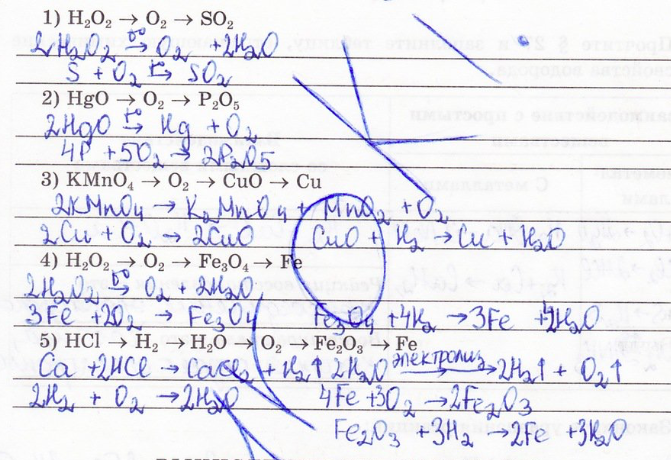
ВЫЧИСЛЕНИЯ ОБЪЕМОВ ГАЗОВ
9. Пользуясь формулой Vm=V:n [л/моль], вычислите:
1) какой объем при н.у. занимают:
а) 0,2 моль кислорода - 0,2*22,4 = 4,48 л.
б) 3 моль азтоа - 3*22,4 = 67,2 л.
в) 1,3 моль аргона - 1,3*22,4 = 29,12 л.
2) какому количеству вещества при н.у. соответствует:
а) 11,2 л кислорода - 11,2:22,4 = 0,5 моль.
б) 5,6 л азота - 5,6:22,4 = 0,25 моль.
в) 44,8 л аргона - 44,8:22,4 = 2 моль.
3) какой объем займет при н.у.:
а) азот массой 280 г - v=280/28=10 моль. 10*22,4 = 224 л.
б) оксид серы (4) массой 6,4 г - v=3,2/32=0,1 моль. 0,1*22,4 = 2,24 л.
в) кислород массой 6,4 г - v=6,4/32=0,2 моль. 0,2*22,4 = 4,48 л.
4) массу:
а) углкислого газа при н.у. объемом 2 мл - v=0,002/22,4 = 0,00009 моль. 0,00009*32= 0,0029 г.
б) кислорода объемом 5,6 л - v=5,6/22,4=0,25 моль. 0,25*32 = 8 г.
в) массу аммиака объемом 8,96 л - v=8,96/22,4=0,4 моль. 0,4*17=6,8 г.
10. Задача. Вычислить объем водорода, затраченного для получения 13 г меди из оксида.


11. Задача. Какой объем водорода требукется для реакции с серой массой 9,6 г.


12. Задача. Вычислите объем водорода, образующегося при взаимодействии 6,5 г цинка с соляной кислотой. Сколько (г) оксида фольфрама (4) можно восстановить этим водородом?


13. Задача. Вычислите массу оксида хрома (3), необходиомго для получения 10,4 г хрома. Сколько (г) цинка потребуется растворить в соляной кислоте, чтобы получить водород необходимого объема?


Урок 23. Горение и медленное окисление. Тепловой эффект химической реакции - стр. 67-71Уроки 27-29. Вода - растворитель. Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде. Массовая доля растворенного вещества. Практическая работа "Приготовление раствора солей с определенной массовой долей вещества" - стр. 78-81
Сохраните или поделитесь с одноклассниками:

