Урок 17. Вычисления по уравнениям химических реакций - cтраницы 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53
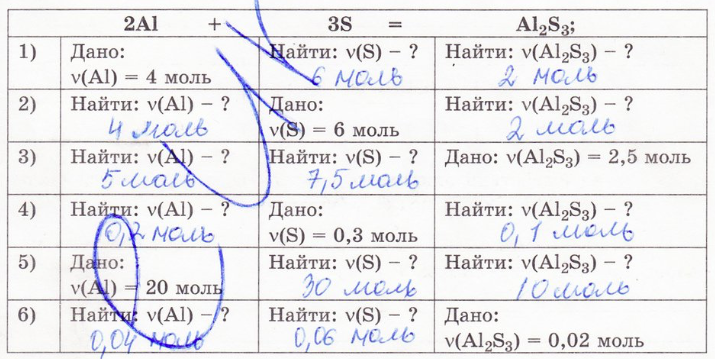
1. Заполните таблицу, решив 6 задач (условия приведены по горизонтали).

2. Расставьте коэффициенты в уравнении химической реакции, составьте количественные отношения веществ по уравнению:


3. Расставьте коэффициенты в уравнении химической реакции, составьте количественные отношения веществ по уравнению:
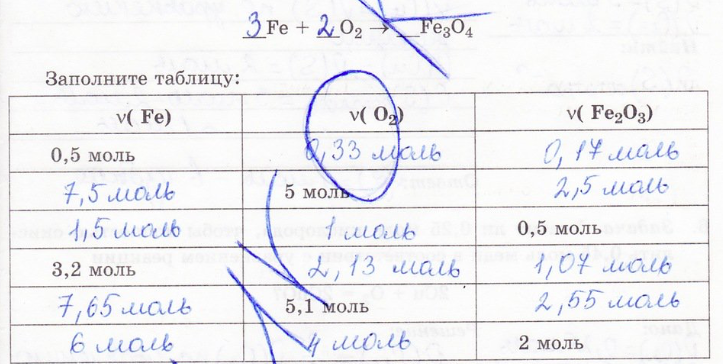
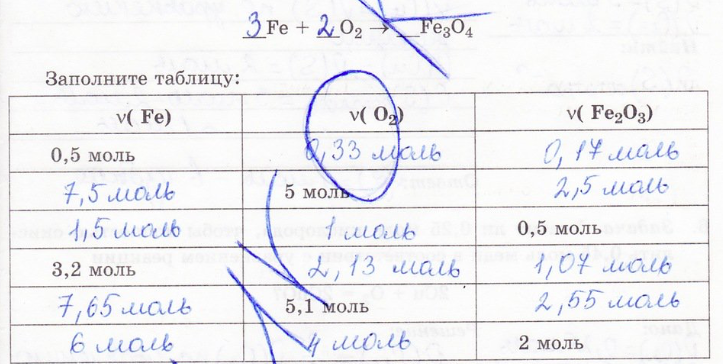
4. При взаимодействии алюминия с кислородом образовался оксид алюминия (4Al+3O2=2Al2O3). Определите:
а) количество вещества алюминия, если в реакцию вступил кислород количеством вещества 3 моль.
v(AC) = 3 моль:3*4 = 4 моль.
б) количество вещества кислорода, вступившего в реакцию, если в результате образовалось 6 моль оксида алюминия.
О(О2) = 6:2*3 = 9 моль.
в) количество вещества образовавшегося оксида алюминия, если в реакцию вступил алюминий, количеством вещества 5 моль.
О(Al2O3) = 5:2 = 2,5 моль.
а) количество вещества алюминия, если в реакцию вступил кислород количеством вещества 3 моль.
v(AC) = 3 моль:3*4 = 4 моль.
б) количество вещества кислорода, вступившего в реакцию, если в результате образовалось 6 моль оксида алюминия.
О(О2) = 6:2*3 = 9 моль.
в) количество вещества образовавшегося оксида алюминия, если в реакцию вступил алюминий, количеством вещества 5 моль.
О(Al2O3) = 5:2 = 2,5 моль.
5. Задача. Смешали 3 моль серы и 2 моль порошка меди и нагрели. Полностью ли вещества вступят в реакцию в соответствии с уравнением реакции


6. Задача. Хватит ли 0,25 моль кислорода, чтобы полностью окислить 0,45 моль меди в соответствии с уравнением реакции


7. Задача. Каково количество вещества кислорода требуемого для получения оксида железа (Fe3O4) из 2,5 моль железа в соответствии с уравнением реакции 3Fe+2O2 = Fe3O4?


8. Задача. Уравнение реакции между соляной кислотой и оксидом кальция: 2HCl+CaO = CaCl2+H2O. Вычислите количество вещества соляной кислоты, требуемое для получения 0,25 моль хлорида кальция.


9. Задача. По уравнению химической реакции 2Cu+O2 = 2CuO вычислить массу меди, вступившей в реакцию с 0,5 моль кислорода.
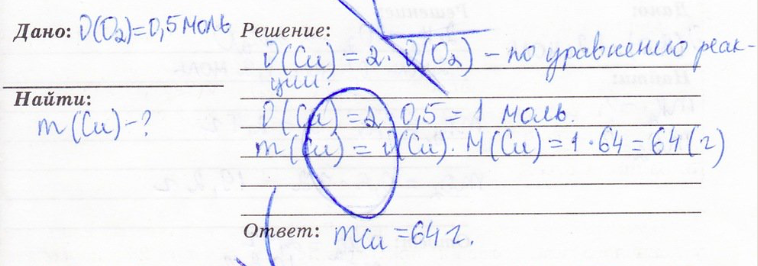
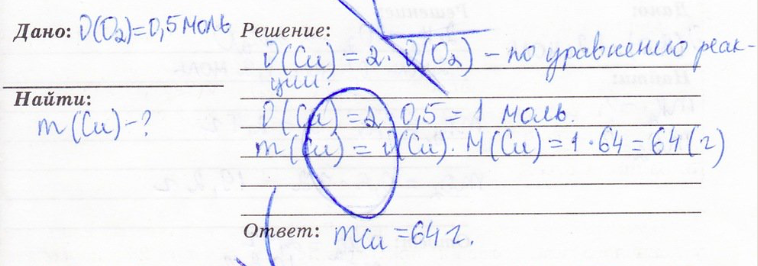
10. Задача. По уравнению химической реакции 2Al+3S = Al2S3 найдите массу сульфида алюминия, образовавшегося из 3,5 моль алюминия.


11. Задача. При взаимодействии алюминия с хлором Cl2 образуется 0,3 моль хлорида алюминия AlCl3. Вычислить массу алюминия и хлора, вступивших в реакцию.


12. Задача. При реакции водорода Н2 с кислородом О2 образуется вода, количеством вещества 1,2 моль. Вычислить массы веществ, вступивших в реакцию.


13. Задача. При разложении малахита (CuOH)2CO3 образуются вода, оксид меди (II) и углекислый газ. Вычислите, сколько граммов малахита разложили, если образовалось 0,25 моль оксида меди (II)?


14. Задача. По уравнению химической реакции 2Cu+O2 = 2CuO вычислить массу меди, вступившей в реакцию с 8 г кислорода.


15. Задача. По уравнению химической реакции, 2Al+3S = Al2S3, найдите массу сульфида алюминия, образовавшегося из 5,4 г алюминия.


16. Задача. При взаимодействии алюминия с хлором Cl2 образуется 26,7 г хлорида алюминия AlCl2. Вычислить массу алюминия и хлора, вступивших в реакцию.


17. Задача. При реакции водорода H2 с кислородо О2 образуется вода массой 72 г. Вычислить массы веществ, вступивших в реакцию.


18. Задача. При разложении малахита (CuOH)2CO3 образуется вода, оксид меди (II) и углекислый газ. Вычислите массу разложившегося малахита, если образовалось 10 г оксида меди (II).


Дополнительные задачи
1. Какое количество вещества водорода и кислорода нужно взять, чтобы получить воду количеством вещества 6 моль?
2H2+O2 -> 2H2O
v(H2) = 6 моль.
v(O2) = 3 моль.
2. Какое количество вещества оксида магния получится при реакции 3 моль магния с кислородом?
2Mg+O2 -> 2MgO
v(MgO) = v(Mg) = 3 моль.
3. Какое количество вещества алюминия потребуется для замещения хрома в 1,5 моль его оксида (III)?
2Al+Cr2O3 -> Al2O3+2Cr
v(Al) = 2*O(Cr2O3) = 2*1,5 = 3 моль.
4. Какое количество вещестав малахита подверглось разложению, если в результате реакции образовалось 0,4 моль оксида меди.
(CuOH)2CO3 -> 2CuO+H2O+CO2
v(CuOH)2CO3 = 1/2v(CuO) = 1/2*0,4 = 0,2 моль.
5. В результате какой реакции выделяется большое количество вещества кислорода в расчете на 1 моль исходного вещества:

6. Кислород в лаборатории можно получать по реакции, уравнение которой 2H2O2=2H2O+O2. Хватит ли кислорода, полученного из 0,4 моль перекиси водорода, для сжигания 0,4 моль фосфора по уравнению 4Р+5О2 = 2Р2О5?
v(O2) = 0,2 моль. Для 0,4 моль Р необходимо 0,4:4*5 = 0,5 моль.
Не хватит.
7. Какое количество вещества цинка может вступить в реакцию с хлором, выделившимся пр взаимодействии 0,15 моль оксида марганца (IV) с концентрированной соляной кислотой по уравнению 4HCl+NgO2 = NgCl2+2H2O+Cl2?
v(Cl2) = v(MnO2) = 0,15 моль.
Zn+Cl2 -> ZnCl2
v(Zn) = v(Cl2) = 0,15 моль.
8. Какое количество вещества метана сгорит (с образованием углекислого газа и воды) в кислороде, образовавшемся из 0,2 моль перманганата калия по уравнению 2KMnO4 = MnO2 + K2MnO4 + O2?
v(O2) = 1/2v(KMnO4) = 1/2*0,2 = 0,1 моль
CH4+2O2 -> CO2+2H2O
v(CH4) = 1/2)vO2) = 0,05 моль
9. Какое количество вещества углерода потребуется для получения в лаборатории 414 г свинца из его оксида по уравнению: PbO+C = Pb+CO?
v(C) = v(Pb) = 414/207 = 2 моль.
10. Для получения меди используют реакцию, уравнение которой CuO+H2 = Cu + H2O. Какое количество вещества оксида меди (II) надо взять, чтобы получить 128 г меди?

Урок 16. Моль - единица количества вещества. Молярная масса - стр. 39-41Урок 18. Проверь свои знания по теме: Первоначальные химические понятия - стр. 54-56
Сохраните или поделитесь с одноклассниками:

