Урок 14. Закон сохранения массы веществ. Уравнение химической реакции - cтраницы 33, 34, 35, 36, 37, 38
1. Что такое уравнение химической реакции?
Условная запись химической реакции посредством химическмх знаков и формул.
Условная запись химической реакции посредством химическмх знаков и формул.
2. Что записывают в левой части уравнения? В правой?
В левой части пишут формулы веществ, вступающих в реакцию; в правой части - формулы веществ, образующихся в результате.
В левой части пишут формулы веществ, вступающих в реакцию; в правой части - формулы веществ, образующихся в результате.
3. Что означает знак "+" в левой части уравнения? В правой?
Взаимодействие изначальных веществ - в левой части; в правой - образующихся веществ.
Взаимодействие изначальных веществ - в левой части; в правой - образующихся веществ.
4. Что такое коэффициенты уравнения реакции? Зачем их расставляют?
Коэффициент - число перед формулой - расставляют, чтобы действовал закон сохранения массы веществ.
Коэффициент - число перед формулой - расставляют, чтобы действовал закон сохранения массы веществ.
5. Что обозначает запись: С+О2=СО2?
В реакцию вступает углерод с кислородом, образуется углекислый газ.
В реакцию вступает углерод с кислородом, образуется углекислый газ.
6. Что обозначает запись?


7. Изменится ли смысл уравнения, если поменять местами его левую или правую части?
Изменится. Реакция также не сможет протекать в большинстве случаев.
Изменится. Реакция также не сможет протекать в большинстве случаев.
8. Вычислить число атомов:




9. Вычислить число атомов:
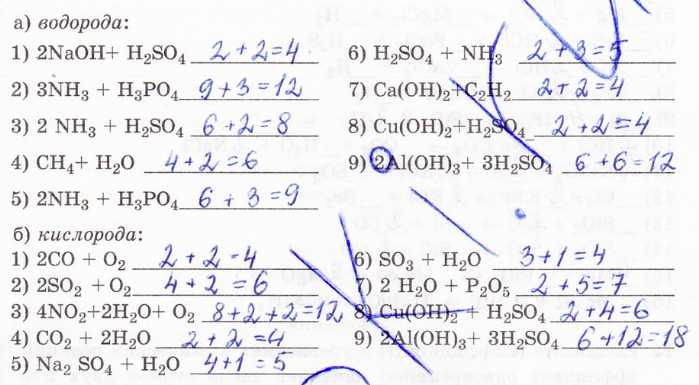
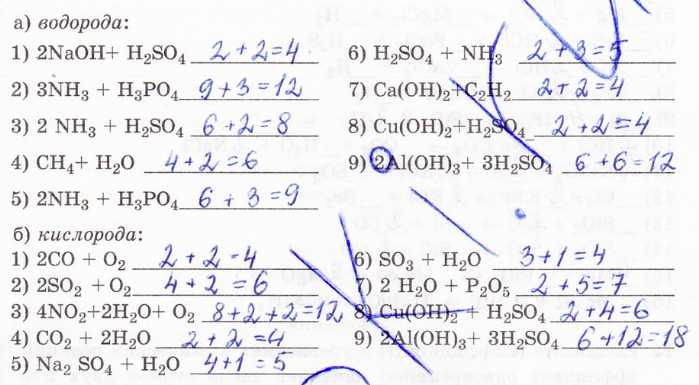
10. Расставьте коэффициенты в уравнениях химических реакций (коэффициент изменяет число атомов только одного элемента):
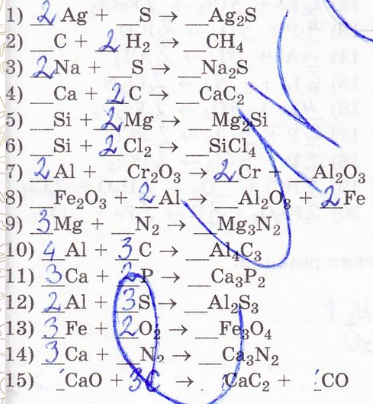

11. Расставьте коэффициенты в уравнениях химических реакций (коэффициент одновременно изменяет число атомов двух элементов):
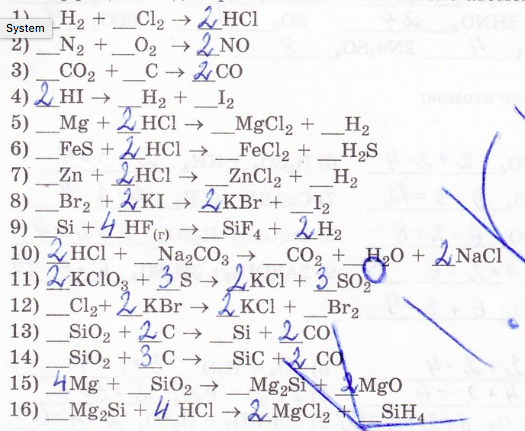

12. Расставьте коэффициенты в уравнениях химических реакций (коэффициент одновременно изменяет число атомов двух или нескольких элементов):
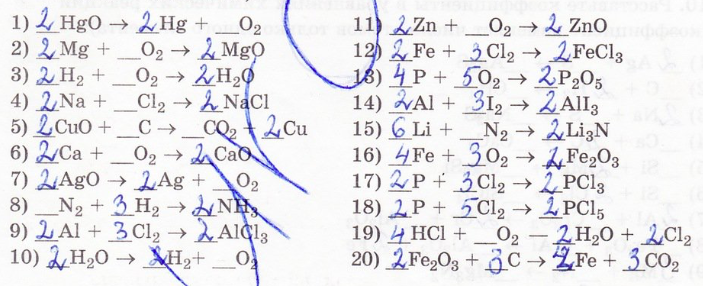
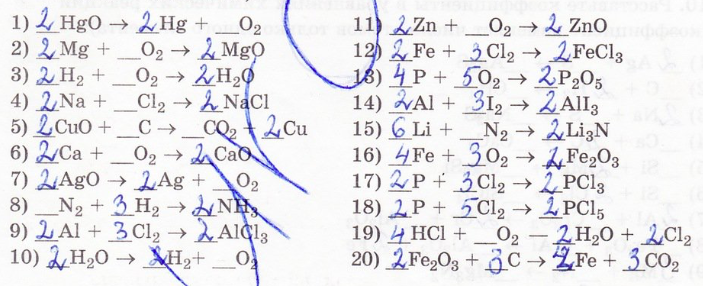
13. Закончите уравнения химических реакций:
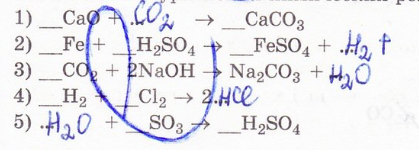
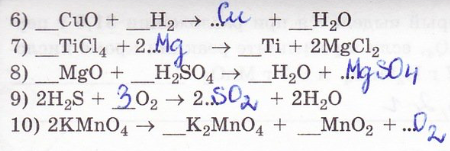
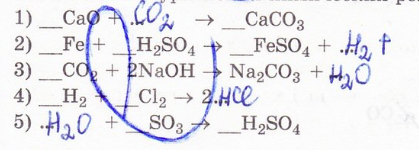
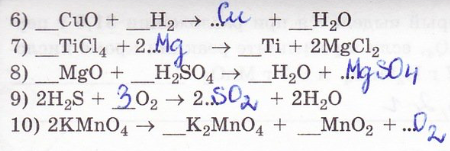
14. Исправьте ошибки в уравнениях химических реакций.
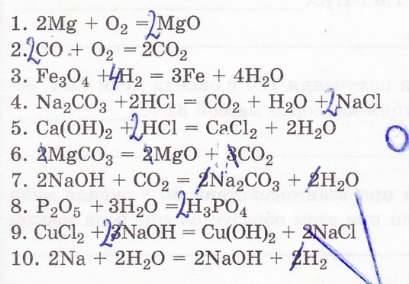
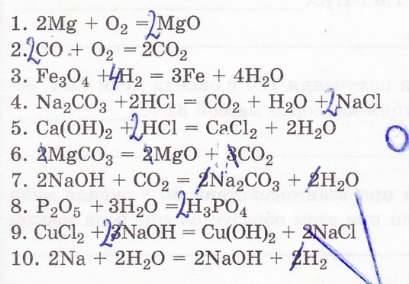
15. Составьте уравнения химическиъ реакций.


16. Задачи. Пользуясь законом сохранения массы, вычислите:
1) массу воды, образующейся из 4 г водорода и 32 г кислорода (2Н2+О2=2Н2О) - 36 г.
2) массу кислорода, который выделитеся при разложении 31,6 г перманганата калия KMnO4, если в результате реакции кроме кислорода образовалось 19,7 г K2MnO4 и 8,7 г MnO2. - 31,6-19,7-8,7 = 3,2 г.
3) массу малахита (CuOH)2CO3 , при разложении которого образовалось 16 г CuO, 4,4 г CO2 и 1,8 г Н2О. - 16+4,4+1,8 = 22,2 г.
4) массу меди, требуемую для получения 120 г оксида меди CuO, если в реакцию с медью вступил кислород массой 32 г. - 120-32 = 88 г.
5) массу меди, образующейся при взаимодействии 80 г оксида меди CuO и 2 г водорода Н2, если при этом образуется еще вода массой 18 г. - 80+2-18 = 64 г.
1) массу воды, образующейся из 4 г водорода и 32 г кислорода (2Н2+О2=2Н2О) - 36 г.
2) массу кислорода, который выделитеся при разложении 31,6 г перманганата калия KMnO4, если в результате реакции кроме кислорода образовалось 19,7 г K2MnO4 и 8,7 г MnO2. - 31,6-19,7-8,7 = 3,2 г.
3) массу малахита (CuOH)2CO3 , при разложении которого образовалось 16 г CuO, 4,4 г CO2 и 1,8 г Н2О. - 16+4,4+1,8 = 22,2 г.
4) массу меди, требуемую для получения 120 г оксида меди CuO, если в реакцию с медью вступил кислород массой 32 г. - 120-32 = 88 г.
5) массу меди, образующейся при взаимодействии 80 г оксида меди CuO и 2 г водорода Н2, если при этом образуется еще вода массой 18 г. - 80+2-18 = 64 г.
Уроки 12-13. Валентность химических элементов. Составление химических формул по валентности - стр. 29-32Урок 15. Классификация химических реакций по числу и составу исходных и полученных веществ - стр. 38-39
Сохраните или поделитесь с одноклассниками:

