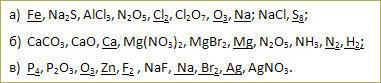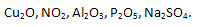Уроки 9-10. Закон постоянства состава. Относительная молекулярная масса. Химические формулы. - cтраницы 21, 22, 23, 24
1. Прочитайте §9. Вычислите по аналогии:
а) массу серы, реагирующей без остатка с железом массой 33,6 г, если вещества железо и сера взаимодействуют друг с другом в массовом соотношении 7:4.
7 г Fe соединяется с 4 г S
33,6 г Fe соединяется с Х г S
Х=33,6•4/7=19,2 г.
Ответ: 19,2 г.
б) массу кислорода, реагирующего без остатка с медью массой 6,5 г, если вещества медь и кислород взаимодействуют друг с другом в массовом соотношении 4:1.
4 г Cu→1 г 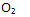
6,5 Сu→Х г 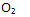
Х=6,5•1/4=1,625 г.
Ответ: 1,625 г.
в) смешали серу массой 20 г с железом массой 33,6 г. Смесь нагрели до начала химической реакции. Найдите массу образовавшегося соединения (сульфида железа), если вещества железо и сера взаимодействуют друг с другом в массовом соотношении 7:4. Определите массу серы, не вступившей в реакцию (избыток).
Если Fe и S реагируют в соотношении 7 и 4, значит, 7 г Fe вступит в реакцию с 4 г S:
взаимодействуют друг с другом в массовом соотношении 7:4.
7 г Fe соединяется с 4 г S
33,6 г Fe соединяется с Х г S
Х=33,6•4/7=19,2 г.
Fe + S = FeS
M (изб. S) = 20-19,2=0,8 г.
Ответ: 0,8 г.
2. Прочитайте §10. Вычислите по аналогии состав следующих соединений, запишите формулы, используя символы химических элементов и индексы и учитывая, что кислород записывается на втором месте:
а) в оксиде меди химические элементы медь и кислород связаны в массовых соотношениях 4:1.
CuO
64 г Cu – 16 г О
4 г Cu – 1 г О
б) в оксиде серы химические элементы сера и кислород связаны в массовых соотношениях 1:1.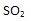
32 г S и 16•2 г О
в) в оксиде серы химические элементы сера и кислород связаны в массовых соотношениях 2:3. 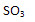
32 г S - 16•3=48 г О
2 г S – 3 г О.
г) в оксиде железа химические элементы железо и кислород связаны в массовых соотношениях 7:3.
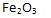
2•56 г Fe и 3•16=О.
д) в этиловом спирте массовые отношения элементов m(C) : m(H) : m(О) =12:3:8. 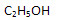
2•12:6•1:1•16
24 г С, 6 г Н и 16 г О.
3.
а) Задача. Врачи констатируют, что кариес зубов в наше время - самая распространенная болезнь. Если ее запустить, кариозная полость доходит до пульпы - ткани, содержащей нервы, кровеносные и лимфатические сосуды. Врач вынужден убить нерв. Для этого использовался «мышьяк» - паста, содержащая мышьяковистую кислоту (m (Н) : m(As) : m(О) = 1 : 25 : 16), которая быстро проникала в пульпу и через 24-48 часов - зуб был мертв. Теперь врач мог безболезненно его обработать и поставить пломбу. По имеющимся данным установите формулу мышьяковистой кислоты.
б) Задача. Известно, что марганец в организме ускоряет образование антител, нейтрализующих вредное воздействие чужеродных белков. Так, внутривенным вливанием соли, содержащей марганец, удается спасти человека, укушенного каракуртом - ядовитейшим из среднеазиатских пауков. Установите формулу соли по следующим данным: m(K) : m(Mn) : m(О) = 32 : 55 : 64.
5. Индекс показывает число атомов данного элемента.
- молекула азота состоит из двух атомов азота – N2;
- молекула аргона состоит из одного атома аргона - Ar;
- в состав поваренной соли входит один атом натрия и один атом хлора - NaCl;
- молекула азотной кислоты состоит из одного атома водорода, одного атома азота и трех атомов кислорода – HNO3;
- двухатомная молекула брома – Br2;
- молекула озона состоит из трех атомов кислорода – O3.
8. Запишите с помощью символов, индексов и коэффициентов:
- пять молекул воды – 5H2O;
- два атома кислорода – 2O;
- шесть двухатомных молекул хлора – 6Cl2;
- три атома хлора – 3Cl.
9. Что обозначает запись?
- 2Н – два атома водорода;
- 5Na – пять атомов натрия;
- 7О2 – семь молекул кислорода;
- 3Р4 – три молекулы фосфора;
- 10С – десять атомов углерода.
10. Рассчитайте относительную молекулярную массу (Мг) следующих соединений:
a) Mr(SО3) = 1•Ar(S) + 3•Ar(O)= 32+3•16=80
Мr(РСl5) = 1•Ar(P) + 5•Ar(Cl)=31+ 5•35,5=208,5
Mr(CuCl2) = 1•Ar(Cu) + 2•Ar(Cl)=64+35,5•2=135
Mr(SiCl4) = 1•Ar(Si) + 4•Ar(Cl)=28+4•35,5=170
б) Mr(P2O3) = 2•Ar(P) + 3•Ar(O)=2•31+ 3•16=110
Mr(Сl2O7) =2•Ar(Cl) + 7•Ar(O)= 2•35,5+7•16=183
Mr(N2O5) =2•Ar(N) + 5•Ar(O)= 2•14+5•16=108
Mr(Al2S3) =2•Ar(Al) + 3•Ar(S)= 2•27+3•32=150
в) Mr(K3PO4) =3•Ar(K) + 1•Ar(P) + 4•Ar(O)= 212
Mr(K2SO3) =2•Ar(K) + 1•Ar(S) + 3•Ar(O)= 158
Mr(Na2SO4) = 2•Ar(Na) + 1•Ar(S) + 4•Ar(O)= 142
Mr(AgNO3) = 1•Ar(Ag) + 1•Ar(N) + 3•Ar(O)= 170
г) Mr(Zn(NO3)2) =2•Ar(Zn) + 2•Ar(N) + 6•Ar(O)=189
Mr(Cu(OH)2) = 1•Ar(Cu) + 2•Ar(H) + 2•Ar(O)=98
Mr(Fe(OH)3)= 1•Ar(Fe) + 3•Ar(H) + 3•Ar(O)=107
Mr(Al2(SO4)3)= 2•Ar(Al) + 3•Ar(S) + 12•Ar(O)=342
д) Mr(CuSO4•5H2O)= 1•Ar(Cu) + 1•Ar(S) + 4•Ar(O)+ 5Mr(H2O)=250
Mr(Na2CO3 • 10H2O)=2•23+12+48+10•18=286
13. Определите массовые отношения элементов в следующих соединениях:
m(Cu) : m(O)=2•64 : 16=128 : 16=8:1
m(Na) : m(O)=14 : 2•16=14:32=7:16
m(Al) : m(O)=2•27 : 3•16 = 54:48=9:8
m(Na) : m(S) : m(O)= 2•23 : 32 : 4•16=46:32:64=23:16:32
Сохраните или поделитесь с одноклассниками: