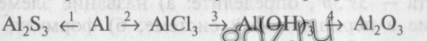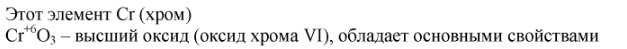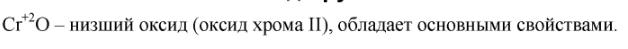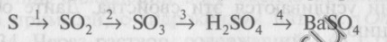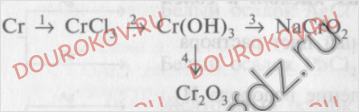Итоговая работа по курсу общей химии
1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Дайте характеристику реакции 2 с точки зрения различных классификаций (см. схему в работе 1, тема IV). Выберите окислительно-восстановительный процесс, назовите окислитель и восстановитель. Уравнение реакции обмена напишите в молекулярной и краткой ионной формах. Назовите исходные вещества и продукты этой реакции.
2. Напишите формулы гидроксидов химических элементов 3-го периода, обладающих основными свойствами. Отметьте, в каком направлении усиливаются эти свойства. Дайте объяснение этому явлению.
Напишите молекулярное и краткое ионное уравнение реакции, характеризующей свойства наиболее слабого основания из выбранных вами.
3. Зная формулу внешнего электронного слоя атома химического элемента – 4s2 4p4, определите: а) название элемента и его положение в периодической системе; б) формулу, название и характер свойств его высшего оксида.
4. К раствору, содержащему 16 г сульфата меди (II), добавили 12 г железных стружек. Рассчитайте массу меди, которая при этом выделится. (Ответ: 6,34 г).
1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Дайте характеристику реакции 4 с точки зрения различных классификаций (см. схему в работе 1, тема IV). Выберите окислительно-восстановительные процессы, в одном из них назовите окислитель и восстановитель. Уравнение реакции обмена напишите в молекулярной и краткой ионной формах. Назовите исходные вещества и продукты этой реакции.
2. Напишите формулы таких водородных соединений химических элементов 3-го периода, в которых водород имеет степень окисления +1. Выберите из них формулу вещества, которое наиболее активно реагирует с щелочью. Напишите уравнение этой реакции. Какие свойства проявляет в этом случае водородное соединение?
3. Напишите формулу высшего оксида d-элемента, расположенного в 4-м периоде и VIБ-группе периодической системы химических элементов. Дайте название веществу, определите характер его свойств. Какими свойствами обладает низший оксид этого химического элемента?
4. Рассчитайте массу фосфорной кислоты, которую можно получить из 80 г фосфата кальция при его взаимодействии с концентрированной серной кислотой. Массовая доля выхода кислоты составляет 96%. (Ответ: 48,6 г.)
1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Дайте характеристику реакций 3 с точки зрения различных классификаций (см. схему в работе 1, тема IV). Выберите окислительно-восстановительные процессы, в одном из них назовите окислитель и восстановитель. Уравнение реакции обмена напишите в молекулярной и краткой ионной формах. Назовите исходные вещества и продукты этой реакции.
2. Напишите формулы гидроксидов химических элементов 3-го периода, обладающих кислотными свойствами. Отметьте, в каком направлении усиливаются эти свойства. Дайте объяснение этому явлению.
Напишите молекулярное и краткое ионное уравнения реакции, характеризующей свойства наиболее сильной кислоты, которую вы выбрали.
3. Зная формулу внешнего электронного слоя атома химического элемента – 3s2 3p3, определите: а) название элемента и его положение в периодической системе; б) формулу, название и характер свойств его высшего оксида.
4. Оксид магния массой 10 г обработали раствором, содержащим 40 г азотной кислоты. Рассчитайте массу соли, которая при этом образовалась. (Ответ: 37 г.)
1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Дайте характеристику реакции 4 с точки зрения различных классификаций (см. схему в работе 1, тема IV). Выберите окислительно-восстановительный процесс, назовите окислитель и восстановитель. Уравнение одной из реакций обмена напишите с молекулярной и краткой ионной формах. Назовите исходные вещества и продукты этой реакции.
2. Напишите формулы таких водородных соединений химических элементов 3-го периода, в которых водород проявляет степень окисления -1. Выберите из них формулу вещества, которое наиболее активно реагирует с водой. Напишите уравнение этой реакции. Определите: а) как изменяется степень окисления водорода в выбранном вами соединении – повышается или понижается; б) какую функцию – окислителя или восстановителя – он выполняет.
3. Напишите формулы оксидов химических элементов, расположенных в 4 – м периоде и II группе периодической системы. Дайте названия веществам и укажите характер их свойств.
4. Рассчитайте массу кремния, который образуется при восстановлении углем 60 г оксида кремния (IV), содержащего 5% примесей. (Ответ: 26,6 г.)
Сохраните или поделитесь с одноклассниками: